2017年江西省吉安市中考化學(xué)模擬壓軸題(精編解析版)
由于版式的問題,試題可能會(huì)出現(xiàn)亂碼的現(xiàn)象,為了方便您的閱讀請(qǐng)點(diǎn)擊全屏查看
一、單選題下列屬于物理變化是 ()
A.綠色植物光合作用吸收二氧化碳
B.用糯米等原料做酒
C.分離液態(tài)空氣制氧氣
D.灼燒方法來區(qū)分羊毛和化纖
2.下列說法不正確的是()
A.糖類和油脂可提供能量????????????? B.棉花、羊毛、蠶絲是天然纖維
C.缺鐵會(huì)引起貧血病????????????? D.氧化鈣CaO俗名消石灰
3.實(shí)驗(yàn)操作正確的是()
A. 取用鋅粒????????????? B.
取用鋅粒????????????? B. 熄滅酒精燈?????????????
熄滅酒精燈?????????????
C. 過濾????????????? D.
過濾????????????? D. 稀釋濃硫酸
稀釋濃硫酸
4.我國(guó)科學(xué)家用濾紙和二氧化鈦(TiO2)薄膜制作出一種新型“納米紙”,又在納米紙上“鋪”一層“萘胺”(C10H9N)染料,制成一種試紙,用于檢測(cè)食品中亞硝酸鹽濃度的高低.下列說法正確的是()
A.二氧化鈦中Ti的化合價(jià)為+2
B.萘胺分子中C、H、N的原子個(gè)數(shù)比為10:9:1
C.二氧化鈦和萘胺都是有機(jī)物
D.這種試紙是一種新型化合物
5.如圖所示為某反應(yīng)在同一容器中反應(yīng)前后微粒示意圖.下列說法正確的是()
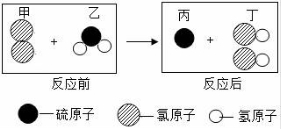
A.反應(yīng)物乙屬于鹽
B.該反應(yīng)的化學(xué)方程式為Cl2+H2O=2HCl+S
C.分子是變化中的最小粒子
D.物質(zhì)丁的溶液pH小于7
6.物質(zhì)的性質(zhì)決定其用途.下列物質(zhì)的用途與性質(zhì)對(duì)應(yīng)關(guān)系錯(cuò)誤的是()
A.氫氧化鈣可用來改良酸性土壤﹣﹣氫氧化鈣溶液呈堿性
B.氮?dú)獬S米鞅Wo(hù)氣﹣﹣氮?dú)饣瘜W(xué)性質(zhì)穩(wěn)定
C.固態(tài)二氧化碳可用于人工降雨﹣﹣二氧化碳能與堿反應(yīng)
D.氧化鈣可做食品干燥劑﹣﹣氧化鈣能與水反應(yīng)
7.除去下列各組物質(zhì)中的雜質(zhì),所用試劑和方法均正確的是()
| 物質(zhì) | 雜質(zhì) | 除雜質(zhì)所用試劑和方法 |
A | H2 | HCl氣體 | 先通過足量Na2CO3溶液,再通過濃硫酸 |
B | KNO3溶液 | AgNO3溶液 | 先加入過量KCl溶液,再過濾 |
C | KCl固體 | KClO3固體 | 加入少量MnO2加熱 |
D | FeSO4溶液 | CuSO4溶液 | 先加過量Fe粉,再過濾 |
A.A????????????? B.B????????????? C.C????????????? D.D
8.鋰電池是一種新型的高能電池,質(zhì)量輕、容量大,頗受手機(jī)、電腦等用戶的青睞,鋰電池的總反應(yīng)式可表示為:Li+MnO2═LiMnO2.下列說法錯(cuò)誤的是()
A.該反應(yīng)前后鋰元素的化合價(jià)發(fā)生了變化
B.LiMnO2中有兩種金屬元素
C.MnO2在反應(yīng)中是催化劑
D.該反應(yīng)屬于化合反應(yīng)
9.下列離子能在pH=2的無色溶液中大量共存的是()
A.SO42﹣、Fe3+、Na+、OH﹣????????????? B.K+、SO42﹣、Cu2+、NO3﹣
C.Cl﹣、K+、SO42﹣、Na+????????????? D.Ca2+、Cl﹣、CO32﹣、Na+
10.下列圖象與對(duì)應(yīng)選項(xiàng)關(guān)系合理的是()
A.
在某溫度下,向一定量接近飽和的硝酸鉀溶液中,不斷加入硝酸鉀晶體
B.
向NaOH溶液中滴中稀鹽酸至過量
C.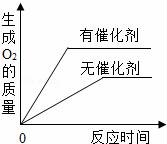
用相等質(zhì)量的雙氧水來制取氧氣
D.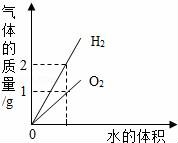
電解水生成氫氣和氧氣
二、選擇填充題
11.下列物質(zhì)屬于純凈物的是 ?? .
A.氫氧化鋇溶液?? B.冰水混合物??? C.黃銅?? D. ?? .
12.下列鑒別物質(zhì)的方法中,切實(shí)可行的是 ?? .
A.用酚酞溶液鑒別NaCl溶液和鹽酸
B.用燃著的木條鑒別CO2和N2
C.用水鑒別NaOH和CaCO3固體
D.鑒別硬水和軟水用 ?? .
13.下列物質(zhì)中含有氧分子的是 ?? .
A.高錳酸鉀?? B.空氣?? C.二氧化碳?? D. ?? .
14.兩種溶液混合后能發(fā)生化學(xué)反應(yīng),且溶液總質(zhì)量不會(huì)發(fā)生變化的是 ?? .
A.氯化鋇溶液和硫酸銅溶液????? B.氯化銨溶液和氫氧化鈉溶液
C.氫氧化鉀溶液和硫酸溶液????? D. ?? .
15.在探究金屬活動(dòng)性順序時(shí),同學(xué)將一定量鋅加入硝酸銀與硝酸銅溶液中充分反應(yīng)后過濾,往濾渣中加稀鹽酸,無氣體生成,以下說法正確的是 ?? .
A.濾液中一定有Ag+ B.濾液中一定有Cu2+ C.濾渣中一定有Ag D.濾液中一定有的陽離子 ?? .
三、填空與分析說明題(共30分)
16.(4分)從碳、氫、氮、氧、鐵五種元素中,選擇適當(dāng)元素符號(hào)用化學(xué)用語填空.
(1)其中的金屬元素 ?? ;
(2)溶液中呈黃色的離子 ?? ;
(3)最簡(jiǎn)單的有機(jī)物的化學(xué)式 ?? ;
(4)標(biāo)出硝酸中氮元素的化合價(jià) ?? .
17.(5分)如圖中的①、②是氟元素、鈣元素在元素周期表中的信息,A、B、C、D是四種結(jié)構(gòu)示意圖.

請(qǐng)你回答:
(I)氟的相對(duì)原子質(zhì)量為 ?? ,鈣的原子序數(shù)為 ?? ;
(2)X= ?? ;該原子結(jié)構(gòu)是一種 ?? 結(jié)構(gòu);
(3)A、B、C、D屬于同種元素的粒子是 ?? (填序號(hào)).
18.(7分)如表是KCl和KNO3在不同溫度下的溶解度.
溫度/℃ | 20 | 30 | 40 | 50 | |
溶解度(g/100g水) | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
(1)硝酸鉀的溶解度隨溫度的升高而 ?? (填“增大”或“減小”).
(2)用同一種方法可以使KCl、KNO3二種物質(zhì)的溶液都析出晶體,該方法是 ?? .
(3)KCl、KNO3兩種物質(zhì)溶解度相等的溫度在 ?? 之間(用編號(hào)表示).
A.20℃以下?? B.20℃~30℃C.30℃~40℃D.40℃~50℃
(4)20℃時(shí),100g水中最多可溶解KCl的質(zhì)量為 ?? ;40℃時(shí),將70gKCl的飽和溶液稀釋成質(zhì)量分?jǐn)?shù)為20%的溶液,需加水 ?? g.
(5)將某溫度下熱的硝酸鉀飽和溶液逐漸冷卻至室溫,下列有關(guān)量隨時(shí)間變化趨勢(shì)的圖象不正確的是 ?? (用編號(hào)表示).
19.(7分)以黃鐵礦為原料(主要成分是FeS2),生產(chǎn)硫酸的簡(jiǎn)要流程圖如圖:
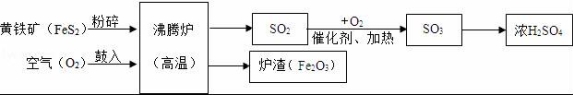
(1)寫出流程圖中一種氧化物的名稱 ?? .
(2)將黃鐵礦粉碎,目的是 ?? .
(3)流程中SO2轉(zhuǎn)化為SO3的化學(xué)方程式為 ?? .
(4)爐渣(Fe2O3)在工業(yè)上可用來 ?? ,請(qǐng)寫出反應(yīng)方程式 ?? .
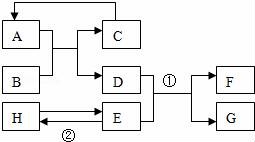
20.(7分)已知A﹣H均為初中化學(xué)常見的物質(zhì).其中A、C是組成元素相同的氣體,且C能產(chǎn)生溫室效應(yīng);B為紅棕色,是赤鐵礦的主要成分;F是紫紅色金屬;H是藍(lán)色沉淀.根據(jù)如圖所示的轉(zhuǎn)化關(guān)系(圖中反應(yīng)條件均已 略去),請(qǐng)回答:
(1)寫出下列物質(zhì)的化學(xué)式:
B ?? 、C ?? ;
(2)寫出下列反應(yīng)的化學(xué)方程式:
① ?? ;
② ?? ;
反應(yīng)②的基本反應(yīng)類型是 ?? .
四、實(shí)驗(yàn)與探究題(共25分)
21.(10分)下列裝置常用于實(shí)驗(yàn)室制取氣體,根據(jù)給出的裝置回答下列問題:
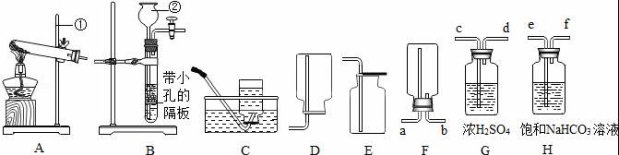
(1)指出編號(hào)儀器名稱:② ?? .
(2)實(shí)驗(yàn)室利用A裝置制取氧氣,反應(yīng)原理用化學(xué)方程式表示為 ?? .利用C裝置收集氧氣的最佳時(shí)刻是 ?? .用收集到的氧氣完成硫粉燃燒實(shí)驗(yàn)后,還需向集氣瓶?jī)?nèi)加入適量氫氧化鈉溶液,目的是 ?? (用化學(xué)方程式表示).
(3)制取并收集二氧化碳應(yīng)選擇的裝置是 ?? ,使用該套發(fā)生裝置制取氣體的突出優(yōu)點(diǎn)是 ?? .若改用F裝置收集二氧化碳,則氣體應(yīng)從 ?? 端進(jìn)入.制得的二氧化碳中常含有少量的氯化氫氣體與水蒸氣,欲用G、H裝置將以上雜質(zhì)氣體除去,則裝置正確的連接順序是:混合氣體→ ?? (用端口字母表示).
22.(6分)遂川“狗牯腦”茶葉享譽(yù)天下,茶葉中含有豐富的有機(jī)物和無機(jī)物,某化學(xué)研究小組測(cè)定茶葉中鈣元素含量的實(shí)驗(yàn)方案如下:
【查閱資料】
(1)茶葉中鋁、鐵元素對(duì)鈣離子的測(cè)定有影響,所以要預(yù)先除去.
(2)溶液中鋁離子、鐵離子完全轉(zhuǎn)化為氫氧化物沉淀的pH在6左右,加熱有利于沉淀聚沉.
(3)茶葉中豐富的有機(jī)物來自于植物進(jìn)行了光合作用.
①稱取100g干燥的茶葉,充分灼燒使茶葉灰化,再用研缽磨細(xì)后移入燒杯中,然后加入一定量稀鹽酸,攪拌、過濾、洗滌.
②向步驟①所得濾液中逐滴加入稀氫氧化鈉溶液,調(diào)節(jié)溶液的pH為6~7左右,再加熱煮沸30min,過濾后得到濾液和沉淀.
③向步驟②所得的濾液中加入足量無水碳酸鈉,充分?jǐn)嚢瑁浞址磻?yīng)后,過濾、洗滌,得到濾液和沉淀.
請(qǐng)回答下列問題:
(1)步驟①中用到的玻璃儀器是 ?? ,灼燒灰化的目的是 ?? .
(2)實(shí)驗(yàn)中用pH試紙測(cè)溶液pH值的方法是 ?? .
(3)寫出步驟②中生成紅褐色沉淀的化學(xué)方程式 ?? .
(4)計(jì)算茶葉中鈣元素的含量還需要測(cè)定的數(shù)據(jù)是 ?? .
23.(9分)通過“金屬和金屬材料”和“燃燒”的復(fù)習(xí),同學(xué)們對(duì)課本上“活動(dòng)性較強(qiáng)的金屬一般可以將位于其后面的金屬?gòu)乃鼈兊柠}溶液中置換出來”以及“支持燃燒的氣體一般是氧氣”這兩句話產(chǎn)生了質(zhì)疑.在老師的幫助下,用金屬鈉來探究下列問題:
提出問題:1、金屬鈉能否置換出硫酸銅溶液中的銅?
?? 2、金屬鈉能否在其他氣體(如:CO2)中燃燒?
資料查閱:金屬Na性質(zhì)活潑,常溫下,它極易與氧氣反應(yīng)生成白色固體氧化鈉,氧化鈉溶于水生成氫氧化鈉.金屬鈉還可以與水劇烈反應(yīng)放出氫氣.
實(shí)驗(yàn)探究:
實(shí)驗(yàn)一:①在實(shí)驗(yàn)室中,金屬鈉保存在煤油中;
②用鑷子從煤油中取出一小塊金屬鈉,用濾紙吸干表面煤油后投入硫酸銅溶液中,觀察到溶液中出現(xiàn)藍(lán)色沉淀,但沒有紅色的物質(zhì)析出;
③按照步驟②將金屬鈉投入水中,反應(yīng)結(jié)束后滴加酚酞溶液,發(fā)現(xiàn)溶液變紅.
實(shí)驗(yàn)二:將燃燒的鈉迅速伸入盛有CO2的集氣瓶中,觀察到鈉在CO2中繼續(xù)燃燒,反應(yīng)后冷卻,瓶?jī)?nèi)附著黑色顆粒,并粘附著白色物質(zhì).
問題討論
(1)根據(jù)上述資料寫出鈉塊投入水中所發(fā)生的反應(yīng)方程式: ??
(2)實(shí)驗(yàn)二中生成的黑色顆粒是 ?? (填化學(xué)式),而白色物質(zhì)可能是什么呢?
①同學(xué)們圍繞白色物質(zhì)可能是什么產(chǎn)生如下猜想:甲認(rèn)為白色物質(zhì)是氧化鈉,乙認(rèn)為是碳酸鈉,丙認(rèn)為是氧化鈉和碳酸鈉的混合物,丁認(rèn)為是氫氧化鈉.我認(rèn)為丁的猜想是錯(cuò)誤的,理由是 ?? .
②對(duì)白色物質(zhì)是什么進(jìn)行實(shí)驗(yàn)再探究,方案設(shè)計(jì)如下:
方案1:取該樣品少量于試管里,加入適量的水,振蕩,過濾,向?yàn)V液中加入無色酚酞試液,觀察到溶液變成紅色,結(jié)論:白色物質(zhì)中一定有氧化鈉.
方案2:取該樣品少量于試管里,滴加足量稀鹽酸,溶液中有氣泡冒出,結(jié)論:白色物質(zhì)中一定有 ?? .
方案3:取該樣品少量于試管里,加入適量的水,振蕩,過濾,向?yàn)V液中加入過量的 ?? 溶液(填標(biāo)號(hào))(供選試劑:A、石灰水B、氯化鈣溶液 C、硫酸銅溶液),出現(xiàn)白色沉淀,然后過濾,再向溶液里滴加無色酚酞試液,無明顯現(xiàn)象出現(xiàn).則 ?? (在甲、乙、丙中選)的猜想成立.
③評(píng)價(jià)與反思:小娟同學(xué)認(rèn)為實(shí)驗(yàn)方案1得出的結(jié)論不正確,其理由是 ?? .實(shí)驗(yàn)室中的金屬鈉著火時(shí),你的滅火方法是 ?? .
五、計(jì)算題(共10分)
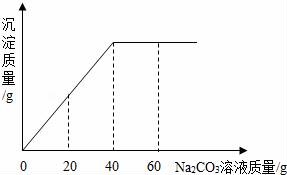
24.(10分)實(shí)驗(yàn)室有一瓶未知濃度的BaCl2溶液,某同學(xué)取出150g該溶液于燒杯中,向其中逐滴加入溶質(zhì)質(zhì)量分?jǐn)?shù)為26.5%的Na2CO3溶液,反應(yīng)過程中生成沉淀的質(zhì)量與所用Na2CO3溶液質(zhì)量的關(guān)系如圖所示.請(qǐng)計(jì)算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固體 ?? g.
(2)BaCl2溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)是多少?(寫出計(jì)算過程,結(jié)果保留到0.1%)
(3)反應(yīng)前后溶液中鋇元素的質(zhì)量 ?? (填“增大”、“減小”或“不變”).
2017年江西省吉安市中考化學(xué)模擬壓軸題參考答案與試題解析
一、單選題(2017?吉安模擬)下列屬于物理變化是 ()
A.綠色植物光合作用吸收二氧化碳
B.用糯米等原料做酒
C.分離液態(tài)空氣制氧氣
D.灼燒方法來區(qū)分羊毛和化纖
【考點(diǎn)】E3:化學(xué)變化和物理變化的判別.
【分析】化學(xué)變化是指有新物質(zhì)生成的變化,物理變化是指沒有新物質(zhì)生成的變化,化學(xué)變化和物理變化的本質(zhì)區(qū)別是否有新物質(zhì)生成;據(jù)此分析判斷.
【解答】解:A、綠色植物光合作用吸收二氧化碳過程中有新物質(zhì)生成,屬于化學(xué)變化.
B、用糯米等原料做酒過程中有新物質(zhì)酒精生成,屬于化學(xué)變化.
C、分離液態(tài)空氣制氧氣過程中沒有新物質(zhì)生成,屬于物理變化.
D、灼燒方法來區(qū)分羊毛和化纖過程中有新物質(zhì)生成,屬于化學(xué)變化.
故選C.
【點(diǎn)評(píng)】本題難度不大,解答時(shí)要分析變化過程中是否有新物質(zhì)生成,若沒有新物質(zhì)生成屬于物理變化,若有新物質(zhì)生成屬于化學(xué)變化.
2.下列說法不正確的是()
A.糖類和油脂可提供能量????????????? B.棉花、羊毛、蠶絲是天然纖維
C.缺鐵會(huì)引起貧血病????????????? D.氧化鈣CaO俗名消石灰
【考點(diǎn)】J2:生命活動(dòng)與六大營(yíng)養(yǎng)素;8L:生石灰的性質(zhì)與用途;I9:有機(jī)高分子材料的分類及鑒別;J1:人體的元素組成與元素對(duì)人體健康的重要作用.
【分析】A、根據(jù)人體的六大營(yíng)養(yǎng)物質(zhì)是:水、無機(jī)鹽、蛋白質(zhì)、脂肪、糖類和維生素,蛋白質(zhì)、脂肪、糖類是給人體提供能量的物質(zhì)解答;
B、根據(jù)棉花和蠶絲的類別解答;
C、根據(jù)元素在人體中的作用解答;
D、根據(jù)氧化鈣CaO俗名生石灰解答.
【解答】解:
A、蛋白質(zhì)和油脂是給人體提供能量的物質(zhì),故正確;
B、羊毛、棉花、蠶絲、麻在自然界中存在,屬于天然纖維,故正確;
C、缺鐵會(huì)引起缺鐵性貧血,故正確;
D、氧化鈣CaO俗名生石灰,消石灰是氫氧化鈣,故錯(cuò)誤.
答案:D
【點(diǎn)評(píng)】本題考查了化學(xué)與生活的知識(shí),完成此題,可以依據(jù)已有的知識(shí)進(jìn)行.
3.實(shí)驗(yàn)操作正確的是()
A.
取用鋅粒????????????? B.
熄滅酒精燈????????????? C.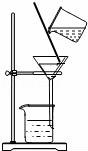
過濾????????????? D.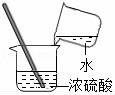
稀釋濃硫酸
【考點(diǎn)】4D:濃硫酸的性質(zhì)及濃硫酸的稀釋;44:加熱器皿﹣酒精燈;48:固體藥品的取用;4G:過濾的原理、方法及其應(yīng)用.
【分析】A、根據(jù)向試管中裝塊狀或顆粒狀固體藥品的方法(“一橫、二放、三慢豎”)進(jìn)行分析判斷.
B、使用酒精燈時(shí)要注意“兩查、兩禁、一不可”.
C、過濾液體時(shí),注意“一貼、二低、三靠”的原則.
D、根據(jù)濃硫酸的稀釋方法(酸入水,沿器壁,慢慢倒,不斷攪)進(jìn)行分析判斷.
【解答】解:A、向試管中裝鋅粒時(shí),先將試管橫放,用鑷子把鋅粒放在試管口,再慢慢將試管豎立起來,圖中所示操作錯(cuò)誤.
B、使用酒精燈時(shí)要注意“兩查、兩禁、一不可”,熄滅酒精燈時(shí),不能用嘴吹滅酒精燈,應(yīng)用燈帽蓋滅,圖中所示操作錯(cuò)誤.
C、過濾液體時(shí),要注意“一貼、二低、三靠”的原則,圖中所示操作正確.
D、稀釋濃硫酸時(shí),要把濃硫酸緩緩地沿器壁注入水中,同時(shí)用玻璃棒不斷攪拌,以使熱量及時(shí)地?cái)U(kuò)散;一定不能把水注入濃硫酸中;圖中所示操作錯(cuò)誤.
故選:C.
【點(diǎn)評(píng)】本題難度不大,熟悉各種儀器的用途及使用注意事項(xiàng)、常見化學(xué)實(shí)驗(yàn)基本操作的注意事項(xiàng)是解答此類試題的關(guān)鍵.
4.我國(guó)科學(xué)家用濾紙和二氧化鈦(TiO2)薄膜制作出一種新型“納米紙”,又在納米紙上“鋪”一層“萘胺”(C10H9N)染料,制成一種試紙,用于檢測(cè)食品中亞硝酸鹽濃度的高低.下列說法正確的是()
A.二氧化鈦中Ti的化合價(jià)為+2
B.萘胺分子中C、H、N的原子個(gè)數(shù)比為10:9:1
C.二氧化鈦和萘胺都是有機(jī)物
D.這種試紙是一種新型化合物
【考點(diǎn)】D1:化學(xué)式的書寫及意義;A7:?jiǎn)钨|(zhì)和化合物的判別;AC:有機(jī)物與無機(jī)物的區(qū)別;D6:有關(guān)元素化合價(jià)的計(jì)算.
【分析】A、根據(jù)在化合物中正負(fù)化合價(jià)代數(shù)和為零,結(jié)合二氧化鈦(TiO2)的化學(xué)式進(jìn)行判斷.
B、根據(jù)1個(gè)“萘胺”(C10H9N)分子的構(gòu)成進(jìn)行分析判斷.
C、含有碳元素的化合物叫有機(jī)化合物,簡(jiǎn)稱有機(jī)物.
D、由不同種元素組成的純凈物是化合物.
【解答】解:A、氧元素顯﹣2價(jià),設(shè)鈦元素的化合價(jià)是x,根據(jù)在化合物中正負(fù)化合價(jià)代數(shù)和為零,可得:x+(﹣2)×2=0,則x=+4價(jià),故選項(xiàng)說法錯(cuò)誤.
B、1個(gè)“萘胺”(C10H9N)分子是由10個(gè)碳原子、9個(gè)氫原子和1個(gè)氮原子構(gòu)成的,則萘胺分子中C、H、N的原子個(gè)數(shù)比為10:9:1,故選項(xiàng)說法正確.
C、二氧化鈦不含碳元素,不屬于有機(jī)物;“萘胺”(C10H9N)是含有碳元素的化合物,屬于有機(jī)物,故選項(xiàng)說法錯(cuò)誤.
D、根據(jù)題意,濾紙和二氧化鈦(TiO2)薄膜制作出一種新型“納米紙”,又在納米紙上“鋪”一層“萘胺”(C10H9N)染料,制成一種試紙,該試紙中含有多種物質(zhì),屬于混合物,故選項(xiàng)說法錯(cuò)誤.
故選B.
【點(diǎn)評(píng)】本題難度不大,考查同學(xué)們結(jié)合新信息、靈活運(yùn)用化學(xué)式的含義與有關(guān)計(jì)算、有機(jī)物與化合物的特征等進(jìn)行分析問題、解決問題的能力.
5.如圖所示為某反應(yīng)在同一容器中反應(yīng)前后微粒示意圖.下列說法正確的是()
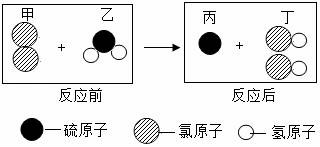
A.反應(yīng)物乙屬于鹽
B.該反應(yīng)的化學(xué)方程式為Cl2+H2O=2HCl+S
C.分子是變化中的最小粒子
D.物質(zhì)丁的溶液pH小于7
【考點(diǎn)】B3:微粒觀點(diǎn)及模型圖的應(yīng)用;99:溶液的酸堿性與pH值的關(guān)系;A9:常見的氧化物、酸、堿和鹽的判別.
【分析】A、根據(jù)微粒示意圖,分析物質(zhì)的類別;
B、根據(jù)物質(zhì)的微觀構(gòu)成,分析反應(yīng)物、生成物,寫出反應(yīng)的方程式;
C、對(duì)比分析反應(yīng)前后微粒的變化,分析分子、原子等的變化;
D、根據(jù)鹽酸溶液的pH小于7.
【解答】解:由物質(zhì)的微觀構(gòu)成可知,反應(yīng)物是氯氣和硫化氫氣體,生成物是硫和氯化氫,反應(yīng)的方程式是:Cl2+H2S=S↓+2HCl;
A、由上述方程式可知,反應(yīng)物乙是H2S,不屬于鹽,故A錯(cuò)誤;
B、由上述分析可知,該反應(yīng)的化學(xué)方程式為:Cl2+H2S=S↓+2HCl,故B錯(cuò)誤;
C、對(duì)比分析反應(yīng)前后微粒構(gòu)成及變化可知,分子在化學(xué)變化中可以再分,分子不是變化中的最小粒子,故C錯(cuò)誤;
D、由上述分析可知,物質(zhì)丁是HCl,溶液為鹽酸,pH小于7.故D說法正確.
故選:D.
【點(diǎn)評(píng)】學(xué)會(huì)利用微粒觀點(diǎn)及模型圖的應(yīng)用;試題通過給出微粒的模型,考查學(xué)生的觀察能力和對(duì)基本概念的理解與運(yùn)用能力.
6.物質(zhì)的性質(zhì)決定其用途.下列物質(zhì)的用途與性質(zhì)對(duì)應(yīng)關(guān)系錯(cuò)誤的是()
A.氫氧化鈣可用來改良酸性土壤﹣﹣氫氧化鈣溶液呈堿性
B.氮?dú)獬S米鞅Wo(hù)氣﹣﹣氮?dú)饣瘜W(xué)性質(zhì)穩(wěn)定
C.固態(tài)二氧化碳可用于人工降雨﹣﹣二氧化碳能與堿反應(yīng)
D.氧化鈣可做食品干燥劑﹣﹣氧化鈣能與水反應(yīng)
【考點(diǎn)】94:常見堿的特性和用途;6K:常見氣體的用途;8L:生石灰的性質(zhì)與用途.
【分析】A、根據(jù)氫氧化鈣的性質(zhì)與用途進(jìn)行分析判斷.
B、根據(jù)氮?dú)獾幕瘜W(xué)性質(zhì)不活潑進(jìn)行分析判斷.
C、干冰是固體的二氧化碳,升華時(shí)吸收大量的熱.
D、氧化鈣能與水反應(yīng)生成氫氧化鈣,據(jù)此進(jìn)行分析判斷.
【解答】解:A、氫氧化鈣溶液呈堿性,能中和酸性土壤,可用來改良酸性土壤,故選項(xiàng)說法正確.
B、氮?dú)饣瘜W(xué)性質(zhì)不活潑,常用作保護(hù)氣,故選項(xiàng)說法正確.
C、干冰是固體的二氧化碳,升華時(shí)吸收大量的熱,可用于人工降雨,故選項(xiàng)說法錯(cuò)誤.
D、氧化鈣能與水反應(yīng)生成氫氧化鈣,可做食品干燥劑,故選項(xiàng)說法正確.
故選C.
【點(diǎn)評(píng)】本題難度不大,是化學(xué)常考的題型,物質(zhì)的性質(zhì)決定物質(zhì)的用途,掌握常見化學(xué)物質(zhì)的性質(zhì)和用途是正確解答此類題的關(guān)鍵.
7.除去下列各組物質(zhì)中的雜質(zhì),所用試劑和方法均正確的是()
| 物質(zhì) | 雜質(zhì) | 除雜質(zhì)所用試劑和方法 |
A | H2 | HCl氣體 | 先通過足量Na2CO3溶液,再通過濃硫酸 |
B | KNO3溶液 | AgNO3溶液 | 先加入過量KCl溶液,再過濾 |
C | KCl固體 | KClO3固體 | 加入少量MnO2加熱 |
D | FeSO4溶液 | CuSO4溶液 | 先加過量Fe粉,再過濾 |
A.A????????????? B.B????????????? C.C????????????? D.D
【考點(diǎn)】2H:物質(zhì)除雜或凈化的探究;4Q:常見氣體的檢驗(yàn)與除雜方法;9H:鹽的化學(xué)性質(zhì).
【分析】根據(jù)原物質(zhì)和雜質(zhì)的性質(zhì)選擇適當(dāng)?shù)某s劑和分離方法,所謂除雜(提純),是指除去雜質(zhì),同時(shí)被提純物質(zhì)不得改變.除雜質(zhì)題至少要滿足兩個(gè)條件:①加入的試劑只能與雜質(zhì)反應(yīng),不能與原物質(zhì)反應(yīng);②反應(yīng)后不能引入新的雜質(zhì).
【解答】解:A、HCl氣體能與足量Na2CO3溶液反應(yīng)生成氯化鈉、水和二氧化碳,能除去雜質(zhì)但引入了新的雜質(zhì)二氧化碳,不符合除雜原則,故選項(xiàng)所采取的方法錯(cuò)誤.
B、AgNO3溶液能與過量KCl溶液反應(yīng)生成氯化銀沉淀和硝酸鉀,能除去雜質(zhì)但引入了新的雜質(zhì)KCl(過量的),不符合除雜原則,故選項(xiàng)所采取的方法錯(cuò)誤.
C、KClO3在二氧化錳的催化作用下生成氯化鉀和氧氣,二氧化錳作催化劑,反應(yīng)前后質(zhì)量不變,能除去雜質(zhì)但引入了新的雜質(zhì)二氧化錳,不符合除雜原則,故選項(xiàng)所采取的方法錯(cuò)誤.
D、過量Fe粉能與CuSO4溶液反應(yīng)生成硫酸亞鐵溶液和銅,再過濾,能除去雜質(zhì)且沒有引入新的雜質(zhì),符合除雜原則,故選項(xiàng)所采取的方法正確.
故選:D.
【點(diǎn)評(píng)】物質(zhì)的分離與除雜是中考的重點(diǎn),也是難點(diǎn),解決除雜問題時(shí),抓住除雜質(zhì)的必需條件(加入的試劑只與雜質(zhì)反應(yīng),反應(yīng)后不能引入新的雜質(zhì))是正確解題的關(guān)鍵.
8.鋰電池是一種新型的高能電池,質(zhì)量輕、容量大,頗受手機(jī)、電腦等用戶的青睞,鋰電池的總反應(yīng)式可表示為:Li+MnO2═LiMnO2.下列說法錯(cuò)誤的是()
A.該反應(yīng)前后鋰元素的化合價(jià)發(fā)生了變化
B.LiMnO2中有兩種金屬元素
C.MnO2在反應(yīng)中是催化劑
D.該反應(yīng)屬于化合反應(yīng)
【考點(diǎn)】HE:資源綜合利用和新能源開發(fā);6J:催化劑的特點(diǎn)與催化作用;C4:元素的簡(jiǎn)單分類;FA:反應(yīng)類型的判定.
【分析】A、根據(jù)反應(yīng)分析反應(yīng)前后鋰元素的化合價(jià)進(jìn)行分析;
B、根據(jù)物質(zhì)的組成進(jìn)行分析判斷;
C、根據(jù)反應(yīng)分析反應(yīng)物、生成物;
D、根據(jù)反應(yīng)物、生成物的種類及反應(yīng)的特點(diǎn)分析反應(yīng)的類型即可.
【解答】解:A、反應(yīng)前,鋰單質(zhì)中鋰元素的化合價(jià)為零,反應(yīng)后LiMnO2中鋰元素的化合價(jià)為+1價(jià),故A說法正確;
B、由亞錳酸鋰的化學(xué)式LiMnO2可知,它是由鋰元素、錳元素和氧元素組成的,有兩種金屬元素,故B說法正確;
C、在反應(yīng)中Mn02是反應(yīng)物,不是催化劑,故C說法錯(cuò)誤;
D、該反應(yīng)由兩種物質(zhì)生成了一種物質(zhì),屬于化合反應(yīng),故D說法正確;
故選C.
【點(diǎn)評(píng)】催化劑具有“針對(duì)性”,即催化劑針對(duì)某個(gè)化學(xué)反應(yīng)來說,才有意義.例如,不能籠統(tǒng)地說:二氧化錳是催化劑,或者催化劑是二氧化錳等;而應(yīng)該表達(dá)為:二氧化錳是過氧化氫(或氯酸鉀)分解的催化劑. 題中的二氧化錳做反應(yīng)物,不是催化劑.
9.下列離子能在pH=2的無色溶液中大量共存的是()
A.SO42﹣、Fe3+、Na+、OH﹣????????????? B.K+、SO42﹣、Cu2+、NO3﹣
C.Cl﹣、K+、SO42﹣、Na+????????????? D.Ca2+、Cl﹣、CO32﹣、Na+
【考點(diǎn)】9R:離子或物質(zhì)的共存問題;99:溶液的酸堿性與pH值的關(guān)系.
【分析】在pH=2的無色溶液中有大量的H+,并根據(jù)離子不能結(jié)合生成水、氣體、沉淀來判斷離子能大量共存的問題,還要注意無色這一信息,如Cu2+在水溶液中為藍(lán)色.
【解答】解:A、Fe3+、OH﹣能結(jié)合生成氫氧化鐵沉淀,H+和OH﹣能結(jié)合生成水,則不能大量共存,故A錯(cuò)誤;
B、離子不能結(jié)合生成水、氣體、沉淀,可以共存,但Cu2+在水溶液中為藍(lán)色,不符合題意,故B錯(cuò)誤;
C、離子不能結(jié)合生成水、氣體、沉淀,且都是無色的,符合題意,故C正確;
D、在pH=2的溶液中,含有大量氫離子,因?yàn)镠+和CO32﹣能結(jié)合生成水和二氧化碳,則不能大量共存,故D錯(cuò)誤;
故選C.
【點(diǎn)評(píng)】本題考查離子的共存問題,學(xué)生應(yīng)注意習(xí)題中的隱含信息,充分利用信息并結(jié)合復(fù)分反應(yīng)發(fā)生的條件來解答此類習(xí)題.
10.下列圖象與對(duì)應(yīng)選項(xiàng)關(guān)系合理的是()
A.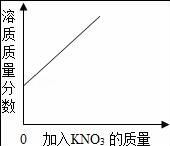
在某溫度下,向一定量接近飽和的硝酸鉀溶液中,不斷加入硝酸鉀晶體
B.
向NaOH溶液中滴中稀鹽酸至過量
C.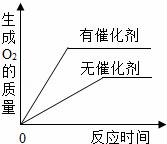
用相等質(zhì)量的雙氧水來制取氧氣
D.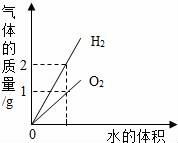
電解水生成氫氣和氧氣
【考點(diǎn)】7R:溶質(zhì)的質(zhì)量分?jǐn)?shù);6J:催化劑的特點(diǎn)與催化作用;71:電解水實(shí)驗(yàn);97:中和反應(yīng)及其應(yīng)用.
【分析】A、根據(jù)飽和溶液的定義來進(jìn)行解答;
B、根據(jù)氫氧化鈉與鹽酸反應(yīng)后pH值減小進(jìn)行分析;
C、過氧化氫分解的過程中催化劑只能改變反應(yīng)速度,不能改變生成物的質(zhì)量解答;
D、根據(jù)通電分解水的實(shí)驗(yàn)現(xiàn)象及結(jié)論進(jìn)行解答.
【解答】解:A、開始硝酸鉀溶液不飽和,還能溶解硝酸鉀,溶質(zhì)質(zhì)量分?jǐn)?shù)增加,當(dāng)硝酸鉀溶液達(dá)到飽和,所以再加入硝酸鉀固體,硝酸鉀不會(huì)溶解,所以溶質(zhì)的質(zhì)量分?jǐn)?shù)也不會(huì)改變,故A錯(cuò);
B、在滴加鹽酸前溶液是氫氧化鈉溶液,pH值大于7,當(dāng)加入鹽酸后,鹽酸與氫氧化鈉反應(yīng)生成氯化鈉和水,pH值減小,恰好完全反應(yīng)時(shí),溶液顯中性,再加入鹽酸,溶液顯酸性,pH值小于7,故B正確;
C、過氧化氫分解的過程中催化劑,只能加快過氧化氫溶液的分解速率而生成氧氣的質(zhì)量在反應(yīng)前后不會(huì)改變,故C錯(cuò);
D、通電分解水時(shí)產(chǎn)生氫氣的體積是氧氣的二倍,不是質(zhì)量比,故D錯(cuò).
故選:B.
【點(diǎn)評(píng)】根據(jù)所給的問題情景及相關(guān)信息,結(jié)合所學(xué)的相關(guān)知識(shí)和技能,聯(lián)系起來細(xì)心地探究、推理后,按照題目要求進(jìn)行選擇或解答即可.
二、選擇填充題
11.下列物質(zhì)屬于純凈物的是 B .
A.氫氧化鋇溶液?? B.冰水混合物??? C.黃銅?? D. 氧氣 .
【考點(diǎn)】A5:純凈物和混合物的判別.
【分析】本題考查利用純凈物的概念來判斷物質(zhì)是否為純凈物,宏觀上看只有一種物質(zhì),微觀上只有一種分子.
【解答】解:A、氫氧化鋇溶液中含有氫氧化鋇和水,屬于混合物,故A錯(cuò);
B、冰水混合物是由水一種物質(zhì)組成,屬于純凈物,故B正確;
C、黃銅是由銅和鋅組成的混合物,故C錯(cuò);
D、氧氣是由一種物質(zhì)組成,屬于純凈物.
故答案為:B;氧氣.
【點(diǎn)評(píng)】在熟悉概念的基礎(chǔ)上能從宏觀和微觀兩個(gè)方面來判斷純凈物和混合物,還要從社會(huì)實(shí)踐中了解生活中常見物質(zhì)的組成.
12.下列鑒別物質(zhì)的方法中,切實(shí)可行的是 C .
A.用酚酞溶液鑒別NaCl溶液和鹽酸
B.用燃著的木條鑒別CO2和N2
C.用水鑒別NaOH和CaCO3固體
D.鑒別硬水和軟水用 肥皂水 .
【考點(diǎn)】AE:物質(zhì)的鑒別、推斷;4Q:常見氣體的檢驗(yàn)與除雜方法;77:硬水與軟水;9U:酸、堿、鹽的鑒別.
【分析】根據(jù)兩種物質(zhì)與同種試劑反應(yīng)產(chǎn)生的不同現(xiàn)象來鑒別它們,若兩種物質(zhì)與同種物質(zhì)反應(yīng)的現(xiàn)象相同,則無法鑒別它們.
【解答】解:A、NaCl溶液和鹽酸分別顯中性、酸性,均不能使酚酞溶液變色,不能鑒別,故選項(xiàng)錯(cuò)誤.
B、CO2和N2均不能燃燒、不能支持燃燒,均能使燃著的木條熄滅,不能鑒別,故選項(xiàng)錯(cuò)誤.
C、NaOH易溶于水,且放出大量的熱,碳酸鈣難溶于水,可以鑒別,故選項(xiàng)正確.
D、硬水和軟水的區(qū)別在于所含的鈣鎂離子的多少,可用肥皂水來區(qū)分硬水和軟水,加入肥皂水,若產(chǎn)生泡沫較多,則是軟水,若產(chǎn)生泡沫較少,則是硬水,可以鑒別.
故答案為:C;肥皂水.
【點(diǎn)評(píng)】本題有一定難度,在解決鑒別物質(zhì)題時(shí),判斷的依據(jù)是:所選試劑需要與待鑒別的物質(zhì)反應(yīng)并出現(xiàn)明顯不同的現(xiàn)象.
13.下列物質(zhì)中含有氧分子的是 B .
A.高錳酸鉀?? B.空氣?? C.二氧化碳?? D. 液態(tài)氧 .
【考點(diǎn)】B2:分子、原子、離子、元素與物質(zhì)之間的關(guān)系.
【分析】根據(jù)已有的知識(shí)進(jìn)行分析,含有氧氣的物質(zhì)則含有氧分子,據(jù)此解答.
【解答】解:A、高錳酸鉀中不含有氧氣,故不含有氧分子,故錯(cuò)誤;
B、空氣中含有氧氣,氧氣是由氧分子構(gòu)成的,故正確;
C、二氧化碳中不含有氧氣,故不含有氧分子,故錯(cuò)誤;
D、液態(tài)氧是氧氣的液態(tài)形式,由氧分子構(gòu)成;
答案:B;液態(tài)氧.
【點(diǎn)評(píng)】本題考查了物質(zhì)的構(gòu)成,完成此題,可以依據(jù)已有的知識(shí)進(jìn)行.
14.兩種溶液混合后能發(fā)生化學(xué)反應(yīng),且溶液總質(zhì)量不會(huì)發(fā)生變化的是 C .
A.氯化鋇溶液和硫酸銅溶液????? B.氯化銨溶液和氫氧化鈉溶液
C.氫氧化鉀溶液和硫酸溶液????? D. 氫氧化鈉溶液與稀鹽酸 .
【考點(diǎn)】9I:復(fù)分解反應(yīng)及其發(fā)生的條件;G1:質(zhì)量守恒定律及其應(yīng)用.
【分析】分析題目有兩個(gè)條件:一是兩溶液混合后要發(fā)生化學(xué)變化,這需要從復(fù)分解反應(yīng)的條件去判斷;二是反應(yīng)后總質(zhì)量不變,即要求反應(yīng)不能生成氣體或沉淀.
【解答】解:A.氯化鋇溶液和硫酸銅溶液反應(yīng)生成氯化銅和硫酸鋇沉淀,溶液質(zhì)量減小;??
B.氯化銨溶液和氫氧化鈉溶液反應(yīng)生成氨氣、水和氯化鈉,溶液質(zhì)量減小;??
C.氫氧化鉀與稀硫酸反應(yīng)生成硫酸鉀和水,沒有氣體或沉淀生成,溶液的質(zhì)量不變;
D.氫氧化鈉與鹽酸反應(yīng)生成氯化鈉和水,沒有氣體或沉淀生成,溶液的質(zhì)量不變.
故答案為:C;D選項(xiàng)答案為:氫氧化鈉溶液與稀鹽酸(答案合理即可).
【點(diǎn)評(píng)】本題考查的是利用復(fù)分解反應(yīng)的條件來判斷反應(yīng)能否發(fā)生以及反應(yīng)后溶液質(zhì)量是否改變,生成氣體、沉淀則質(zhì)量改變,因此要明確物質(zhì)間反應(yīng)的實(shí)驗(yàn)現(xiàn)象.
15.在探究金屬活動(dòng)性順序時(shí),同學(xué)將一定量鋅加入硝酸銀與硝酸銅溶液中充分反應(yīng)后過濾,往濾渣中加稀鹽酸,無氣體生成,以下說法正確的是 C .
A.濾液中一定有Ag+ B.濾液中一定有Cu2+ C.濾渣中一定有Ag D.濾液中一定有的陽離子 Zn2+ .
【考點(diǎn)】85:金屬的化學(xué)性質(zhì).
【分析】根據(jù)金屬活動(dòng)性順序可知,三種金屬的活動(dòng)性為:鋅>銅>銀,將一定量鋅加入硝酸銀與硝酸銅溶液中充分反應(yīng)后,則會(huì)有銅或銀被置換出來,金屬活動(dòng)性越差,被置換出來的可能性越大,充分反應(yīng)后溶液中仍有金屬固體,過濾后往濾渣中加入鹽酸,無氣體產(chǎn)生,說明加入的鋅不過量進(jìn)行分析.
【解答】解:金屬活動(dòng)性順序可知,三種金屬的活動(dòng)性為:鋅>銅>銀,將一定量鋅加入硝酸銀與硝酸銅溶液中充分反應(yīng)后,則會(huì)有銅或銀被置換出來,金屬活動(dòng)性越差,被置換出來的可能性越大,充分反應(yīng)后溶液中仍有金屬固體,過濾后往濾渣中加入鹽酸,無氣體產(chǎn)生,說明加入的鋅不過量,加入的鋅可能與部分硝酸銀、硝酸銅反應(yīng),有可能與全部硝酸銀、硝酸銅反應(yīng),所以
A、濾液中可能有Ag+,故A錯(cuò)誤;
B、濾液中可能有Cu2+,故B錯(cuò)誤;
C、鋅會(huì)先與硝酸銀反應(yīng),所以濾渣中一定有Ag,故C正確;
D、濾液中一定有的陽離子是Zn2+,故D正確.
故答案為:C,Zn2+.
【點(diǎn)評(píng)】本題主要考查了金屬活動(dòng)性順序的應(yīng)用,難度不大,需要在平時(shí)的學(xué)習(xí)中加強(qiáng)記憶即可完成.
三、填空與分析說明題(共30分)
16.從碳、氫、氮、氧、鐵五種元素中,選擇適當(dāng)元素符號(hào)用化學(xué)用語填空.
(1)其中的金屬元素 Fe ;
(2)溶液中呈黃色的離子 Fe3+ ;
(3)最簡(jiǎn)單的有機(jī)物的化學(xué)式 CH4 ;
(4)標(biāo)出硝酸中氮元素的化合價(jià) ![]() H4
H4![]() O3 .
O3 .
【考點(diǎn)】DF:化學(xué)符號(hào)及其周圍數(shù)字的意義.
【分析】本題考查化學(xué)用語的意義及書寫,解題關(guān)鍵是分清化學(xué)用語所表達(dá)的對(duì)象是分子、原子、離子還是化合價(jià),才能在化學(xué)符號(hào)前或其它位置加上適當(dāng)?shù)挠?jì)量數(shù)來完整地表達(dá)其意義,并能根據(jù)物質(zhì)化學(xué)式的書寫規(guī)則正確書寫物質(zhì)的化學(xué)式,才能熟練準(zhǔn)確的解答此類題目.
【解答】解:(1)碳、氫、氮、氧、鐵五種元素中,金屬元素是鐵,其符號(hào)為:Fe;
(2)鐵離子的溶液呈黃色,鐵離子的符號(hào)為:Fe3+;
(3)最簡(jiǎn)單的有機(jī)物是甲烷,其化學(xué)式為:CH4;
(4)元素化合價(jià)的表示方法:確定出化合物中所要標(biāo)出的元素的化合價(jià),然后在其化學(xué)式該元素的上方用正負(fù)號(hào)和數(shù)字表示,正負(fù)號(hào)在前,數(shù)字在后,所以標(biāo)出硝酸中氮元素的化合價(jià),故可表示為:![]() H4
H4![]() O3;
O3;
故答案為:(1)Fe;(2)Fe3+;(3)CH4;(4)![]() H4
H4![]() O3;
O3;
【點(diǎn)評(píng)】本題主要考查學(xué)生對(duì)化學(xué)用語的書寫和理解能力,題目設(shè)計(jì)既包含對(duì)化學(xué)符號(hào)意義的了解,又考查了學(xué)生對(duì)化學(xué)符號(hào)的書寫,考查全面,注重基礎(chǔ),題目難度較易.
17.如圖中的①、②是氟元素、鈣元素在元素周期表中的信息,A、B、C、D是四種結(jié)構(gòu)示意圖.
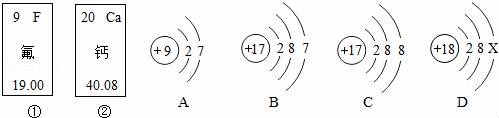
請(qǐng)你回答:
(I)氟的相對(duì)原子質(zhì)量為 19.00 ,鈣的原子序數(shù)為 20 ;
(2)X= 8 ;該原子結(jié)構(gòu)是一種 穩(wěn)定 結(jié)構(gòu);
(3)A、B、C、D屬于同種元素的粒子是 B、C(填序號(hào)).
【考點(diǎn)】C5:元素周期表的特點(diǎn)及其應(yīng)用;B8:原子結(jié)構(gòu)示意圖與離子結(jié)構(gòu)示意圖.
【分析】(1)根據(jù)圖中元素周期表可以獲得的信息,左上角的數(shù)字表示原子序數(shù),漢字下面的數(shù)字表示相對(duì)原子質(zhì)量,進(jìn)行分析解答.
(2)根據(jù)當(dāng)質(zhì)子數(shù)=核外電子數(shù),為原子,進(jìn)行分析解答.
(3)根據(jù)元素是具有相同核電荷數(shù)(即核內(nèi)質(zhì)子數(shù))的一類原子的總稱,決定元素種類的是核電荷數(shù)(即核內(nèi)質(zhì)子數(shù)),據(jù)此進(jìn)行分析解答.
【解答】解:(1)根據(jù)元素周期表中的一格可知,漢字下面的數(shù)字表示相對(duì)原子質(zhì)量,該元素的相對(duì)原子質(zhì)量為19.00;左上角的數(shù)字為,鈣原子的原子序數(shù)為20.
(2)當(dāng)質(zhì)子數(shù)=核外電子數(shù),為原子,18=2+8+X,X=8;最外層電子數(shù)是8,為一種穩(wěn)定結(jié)構(gòu).
(3)根據(jù)決定元素種類的是核電荷數(shù)(即核內(nèi)質(zhì)子數(shù)),因?yàn)锽、C的核內(nèi)質(zhì)子數(shù)相同,所以B、C屬于同種元素的粒子.
故答案為:(1)19.00;20;(2)8;穩(wěn)定;(3)B、C.
【點(diǎn)評(píng)】本題難度不大,靈活運(yùn)用元素周期表中元素的信息(原子序數(shù)、元素符號(hào)、元素名稱、相對(duì)原子質(zhì)量)、粒子結(jié)構(gòu)示意圖的含義是正確解答本題的關(guān)鍵.
18.如表是KCl和KNO3在不同溫度下的溶解度.
溫度/℃ | 20 | 30 | 40 | 50 | |
溶解度(g/100g水) | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
(1)硝酸鉀的溶解度隨溫度的升高而 增大 (填“增大”或“減小”).
(2)用同一種方法可以使KCl、KNO3二種物質(zhì)的溶液都析出晶體,該方法是 蒸發(fā)結(jié)晶 .
(3)KCl、KNO3兩種物質(zhì)溶解度相等的溫度在 B 之間(用編號(hào)表示).
A.20℃以下?? B.20℃~30℃C.30℃~40℃D.40℃~50℃
(4)20℃時(shí),100g水中最多可溶解KCl的質(zhì)量為 34g ;40℃時(shí),將70gKCl的飽和溶液稀釋成質(zhì)量分?jǐn)?shù)為20%的溶液,需加水 30 g.
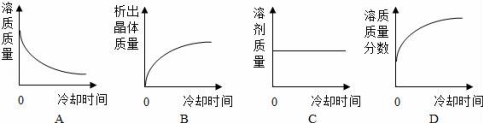
(5)將某溫度下熱的硝酸鉀飽和溶液逐漸冷卻至室溫,下列有關(guān)量隨時(shí)間變化趨勢(shì)的圖象不正確的是 D (用編號(hào)表示).
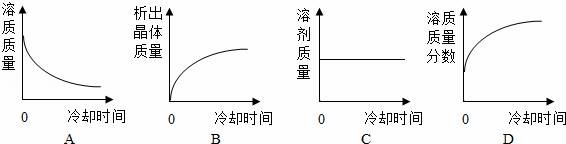
【考點(diǎn)】7M:固體溶解度的影響因素;4H:結(jié)晶的原理、方法及其應(yīng)用;7L:固體溶解度的概念;7R:溶質(zhì)的質(zhì)量分?jǐn)?shù);7S:用水稀釋改變濃度的方法.
【分析】(1)根據(jù)表中不同溫度下硝酸鉀的溶解度分析;
(2)據(jù)KCl、KNO3二種物質(zhì)的溶解度隨溫度變化分析;
(3)分析圖表,KNO3和KCl的溶解度曲線在20℃~30℃溫度范圍內(nèi)相交;
(4)據(jù)稀釋前后溶質(zhì)的質(zhì)量不變解答;
(5)根據(jù)硝酸鉀的溶解度隨著溫度的升高而增大,隨著溫度的降低而減小,將熱的硝酸鉀飽和溶液冷卻到室溫,有硝酸鉀晶體析出進(jìn)行分析判斷;
【解答】解:(1)根據(jù)表中不同溫度下硝酸鉀的溶解度知,硝酸鉀的溶解度隨溫度的升高而增大;
(2)降溫、蒸發(fā)溶劑KCl、KNO3都會(huì)有晶體析出,但降溫KCl析出晶體較少,故用同一種方法可以使KCl、KNO3二種物質(zhì)的溶液都析出晶體的方法是蒸發(fā)結(jié)晶;
(3)分析圖表,KNO3和NaCl的溶解度曲線在20℃~30℃溫度范圍內(nèi)有相同的時(shí)候,所以兩種物質(zhì)的溶解度曲線在此范圍內(nèi)相交;
(4)20℃時(shí)KCl的溶解度為34.0g,所以最多溶解KCl34g,40℃時(shí)KCl的溶解度為40g,則70gKCl中:![]() =20g,
=20g,
設(shè)將70g KCl的飽和溶液稀釋成質(zhì)量分?jǐn)?shù)為20%的溶液,需加水x,
20g=(70+x)×20%,x=30g
(5)硝酸鉀的溶解度隨著溫度的升高而增大,隨著溫度的降低而減小,將熱的硝酸鉀飽和溶液冷卻到室溫,有硝酸鉀晶體析出.
A、將熱的硝酸鉀飽和溶液冷卻到室溫,有硝酸鉀晶體析出,溶液中溶質(zhì)的質(zhì)量減小,故A正確;
B、將熱的硝酸鉀飽和溶液冷卻到室溫,有硝酸鉀晶體析出,應(yīng)該從零開始,故B正確;
C、將熱的硝酸鉀飽和溶液冷卻到室溫,有硝酸鉀晶體析出,溶液中溶質(zhì)的質(zhì)量減小,溶劑的質(zhì)量不變,故C正確;
D、將熱的硝酸鉀飽和溶液冷卻到室溫,有硝酸鉀晶體析出,溶液中溶質(zhì)的質(zhì)量減小,溶劑的質(zhì)量不變,溶質(zhì)質(zhì)量分?jǐn)?shù)逐漸減小,故D錯(cuò)誤.
故選:D.
故答案為:(1)增大;(2)蒸發(fā)結(jié)晶;(3)B;(4)34g;30;(5)D
【點(diǎn)評(píng)】本考點(diǎn)考查了溶解度曲線及其應(yīng)用,通過溶解度曲線我們可以獲得很多信息;還考查了有關(guān)溶液和溶質(zhì)質(zhì)量分?jǐn)?shù)的計(jì)算,有關(guān)的計(jì)算要準(zhǔn)確,本考點(diǎn)主要出現(xiàn)在選擇題和填空題中.
19.以黃鐵礦為原料(主要成分是FeS2),生產(chǎn)硫酸的簡(jiǎn)要流程圖如圖:
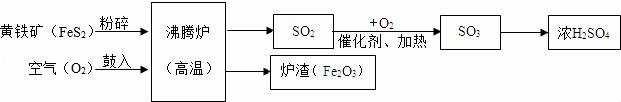
(1)寫出流程圖中一種氧化物的名稱 二氧化硫 .
(2)將黃鐵礦粉碎,目的是 增大反應(yīng)物接觸面積,加快反應(yīng)速率 .
(3)流程中SO2轉(zhuǎn)化為SO3的化學(xué)方程式為 2SO2+O2![]() 2SO3 .
2SO3 .
(4)爐渣(Fe2O3)在工業(yè)上可用來 煉鐵 ,請(qǐng)寫出反應(yīng)方程式 Fe2O3+3CO![]() 2Fe+3CO2 .
2Fe+3CO2 .
【考點(diǎn)】AF:物質(zhì)的相互轉(zhuǎn)化和制備;A3:從組成上識(shí)別氧化物;G5:書寫化學(xué)方程式.
【分析】(1)二氧化硫、三氧化硫和氧化鐵等物質(zhì)都是由氧元素和另外一種元素組成的化合物,都屬于氧化物;
(2)反應(yīng)物接觸面積越大,反應(yīng)速率越快;
(3)一定條件下,二氧化硫和氧氣反應(yīng)生成三氧化硫;
(4)工業(yè)上可以用氧化鐵和一氧化碳在高溫條件下反應(yīng)煉鐵.
【解答】解:(1)流程圖中,二氧化硫、三氧化硫和氧化鐵等物質(zhì)都是氧化物.
故填:二氧化硫.
(2)將黃鐵礦粉碎,目的是增大反應(yīng)物接觸面積,加快反應(yīng)速率.
故填:增大反應(yīng)物接觸面積,加快反應(yīng)速率.
(3)流程中SO2轉(zhuǎn)化為SO3的化學(xué)方程式為:2SO2+O2![]() 2SO3.
2SO3.
故填:2SO2+O2![]() 2SO3.
2SO3.
(4)爐渣(Fe2O3)在工業(yè)上可用來煉鐵,原理是:高溫條件下氧化鐵和一氧化碳反應(yīng)生成鐵和二氧化碳,反應(yīng)的化學(xué)方程式為:Fe2O3+3CO![]() 2Fe+3CO2.
2Fe+3CO2.
故填:Fe2O3+3CO![]() 2Fe+3CO2.
2Fe+3CO2.
故填:煉鐵;Fe2O3+3CO![]() 2Fe+3CO2.
2Fe+3CO2.
【點(diǎn)評(píng)】本題主要考查物質(zhì)的性質(zhì),解答時(shí)要根據(jù)各種物質(zhì)的性質(zhì),結(jié)合各方面條件進(jìn)行分析、判斷,從而得出正確的結(jié)論.
20.已知A﹣H均為初中化學(xué)常見的物質(zhì).其中A、C是組成元素相同的氣體,且C能產(chǎn)生溫室效應(yīng);B為紅棕色,是赤鐵礦的主要成分;F是紫紅色金屬;H是藍(lán)色沉淀.根據(jù)如圖所示的轉(zhuǎn)化關(guān)系(圖中反應(yīng)條件均已 略去),請(qǐng)回答:
(1)寫出下列物質(zhì)的化學(xué)式:
B Fe2O3 、C CO2 ;
(2)寫出下列反應(yīng)的化學(xué)方程式:
① Fe+CuSO4=FeSO4+Cu ;
② 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4 ;
反應(yīng)②的基本反應(yīng)類型是 復(fù)分解反應(yīng) .
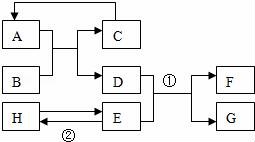
【考點(diǎn)】AE:物質(zhì)的鑒別、推斷;D1:化學(xué)式的書寫及意義;FA:反應(yīng)類型的判定;G5:書寫化學(xué)方程式.
【分析】根據(jù)題干提供的信息進(jìn)行分析解答,A、C是組成元素相同的氣體,且C能產(chǎn)生溫室效應(yīng),故C是二氧化碳,A是一氧化碳;B是紅棕色,是赤鐵礦的主要成分,故B是氧化鐵;氧化鐵能與一氧化碳反應(yīng)生成鐵和二氧化碳,故D是鐵;F是紫紅色金屬,故F是銅;鐵能與E反應(yīng)生成銅,故E可能是硫酸銅溶液,生成的G是硫酸亞鐵;H是藍(lán)色沉淀,故H是氫氧化銅,據(jù)此解答.
【解答】解:A、C是組成元素相同的氣體,且C能產(chǎn)生溫室效應(yīng),故C是二氧化碳,A是一氧化碳;B是紅棕色,是赤鐵礦的主要成分,故B是氧化鐵;氧化鐵能與一氧化碳反應(yīng)生成鐵和二氧化碳,故D是鐵;F是紫紅色金屬,故F是銅;鐵能與E反應(yīng)生成銅,故E可能是硫酸銅溶液,生成的G是硫酸亞鐵;H是藍(lán)色沉淀,故H是氫氧化銅,帶入框圖,推斷合理;
(1)B是氧化鐵,C是二氧化碳,故填:Fe2O3,CO2;
(2)鐵能與硫酸銅反應(yīng)生成硫酸亞鐵和銅,故填:Fe+CuSO4=FeSO4+Cu;
硫酸銅能與氫氧化鈉反應(yīng)生成氫氧化銅沉淀和硫酸鈉,該反應(yīng)是復(fù)分解反應(yīng),故填:2NaOH+CuSO4═Cu(OH)2↓+Na2SO4,復(fù)分解反應(yīng).
【點(diǎn)評(píng)】本題為框圖式物質(zhì)推斷題,解答本題的關(guān)鍵是根據(jù)題干提供的信息推斷得出其他物質(zhì)的化學(xué)式,然后根據(jù)物質(zhì)的性質(zhì)結(jié)合框圖推斷出其他物質(zhì)的化學(xué)式.
四、實(shí)驗(yàn)與探究題(共25分)
21.(10分)(2017?吉安模擬)下列裝置常用于實(shí)驗(yàn)室制取氣體,根據(jù)給出的裝置回答下列問題:
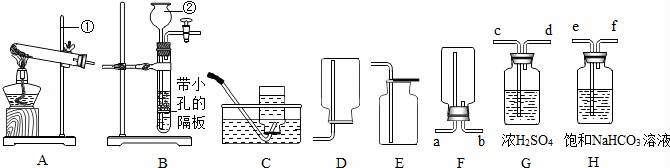
(1)指出編號(hào)儀器名稱:② 長(zhǎng)頸漏斗 .
(2)實(shí)驗(yàn)室利用A裝置制取氧氣,反應(yīng)原理用化學(xué)方程式表示為 2KClO3![]() 2KCl+3O2↑ .利用C裝置收集氧氣的最佳時(shí)刻是 氣泡連續(xù)均勻冒出時(shí)收集 .用收集到的氧氣完成硫粉燃燒實(shí)驗(yàn)后,還需向集氣瓶?jī)?nèi)加入適量氫氧化鈉溶液,目的是 SO2+2NaOH=Na2SO3+H2O (用化學(xué)方程式表示).
2KCl+3O2↑ .利用C裝置收集氧氣的最佳時(shí)刻是 氣泡連續(xù)均勻冒出時(shí)收集 .用收集到的氧氣完成硫粉燃燒實(shí)驗(yàn)后,還需向集氣瓶?jī)?nèi)加入適量氫氧化鈉溶液,目的是 SO2+2NaOH=Na2SO3+H2O (用化學(xué)方程式表示).
(3)制取并收集二氧化碳應(yīng)選擇的裝置是 BE ,使用該套發(fā)生裝置制取氣體的突出優(yōu)點(diǎn)是 可以控制反應(yīng)的發(fā)生和停止 .若改用F裝置收集二氧化碳,則氣體應(yīng)從 b 端進(jìn)入.制得的二氧化碳中常含有少量的氯化氫氣體與水蒸氣,欲用G、H裝置將以上雜質(zhì)氣體除去,則裝置正確的連接順序是:混合氣體→ e→f→c→d (用端口字母表示).
【考點(diǎn)】6L:二氧化碳的實(shí)驗(yàn)室制法;4Q:常見氣體的檢驗(yàn)與除雜方法;6D:氧氣的制取裝置;6G:制取氧氣的操作步驟和注意點(diǎn);G5:書寫化學(xué)方程式.
【分析】(1)根據(jù)實(shí)驗(yàn)室常用儀器的名稱和題中所指儀器的作用進(jìn)行分析;
(2)根據(jù)氯酸鉀在二氧化錳的催化作用下加熱生成氯化鉀和氧氣,用排水法收集氧氣的最佳時(shí)刻是氣泡連續(xù)均勻冒出時(shí)收集,二氧化硫和氫氧化鈉反應(yīng)生成亞硫酸鈉和水進(jìn)行分析;
(3)根據(jù)實(shí)驗(yàn)室制取二氧化碳的反應(yīng)物是固體和液體,反應(yīng)條件是常溫,二氧化碳的密度比空氣大,溶于水,通過裝置內(nèi)壓強(qiáng)的改變可以實(shí)現(xiàn)固體和液體的分離,二氧化碳密度比空氣大,飽和碳酸氫鈉可以吸收氯化氫,濃硫酸有吸水性,洗氣時(shí)應(yīng)該是長(zhǎng)進(jìn)短出進(jìn)行分析.
【解答】解:(1)通過分析題中所指儀器的作用可知,②是長(zhǎng)頸漏斗;
(2)氯酸鉀在二氧化錳的催化作用下加熱生成氯化鉀和氧氣,化學(xué)方程式為:2KClO3![]() 2KCl+3O2↑,用排水法收集氧氣的最佳時(shí)刻是氣泡連續(xù)均勻冒出時(shí)收集,二氧化硫和氫氧化鈉反應(yīng)生成亞硫酸鈉和水,化學(xué)方程式為:SO2+2NaOH=Na2SO3+H2O;
2KCl+3O2↑,用排水法收集氧氣的最佳時(shí)刻是氣泡連續(xù)均勻冒出時(shí)收集,二氧化硫和氫氧化鈉反應(yīng)生成亞硫酸鈉和水,化學(xué)方程式為:SO2+2NaOH=Na2SO3+H2O;
(3)實(shí)驗(yàn)室制取二氧化碳的反應(yīng)物是固體和液體,反應(yīng)條件是常溫,二氧化碳的密度比空氣大,溶于水,所以制取并收集二氧化碳應(yīng)選擇的裝置是BE,通過裝置內(nèi)壓強(qiáng)的改變可以實(shí)現(xiàn)固體和液體的分離,所以使用該套發(fā)生裝置制取氣體的突出優(yōu)點(diǎn)是:可以控制反應(yīng)的發(fā)生和停止,二氧化碳密度比空氣大,所以改用F裝置收集二氧化碳,則氣體應(yīng)從b端進(jìn)入,飽和碳酸氫鈉可以吸收氯化氫,濃硫酸有吸水性,洗氣時(shí)應(yīng)該是長(zhǎng)進(jìn)短出,所以裝置正確的連接順序是:混合氣體→e→f→c→d.
故答案為:(1)長(zhǎng)頸漏斗;
(2)2KClO3![]() 2KCl+3O2↑,氣泡連續(xù)均勻冒出時(shí)收集,SO2+2NaOH=Na2SO3+H2O;
2KCl+3O2↑,氣泡連續(xù)均勻冒出時(shí)收集,SO2+2NaOH=Na2SO3+H2O;
(3)BE,可以控制反應(yīng)的發(fā)生和停止,b,e→f→c→d.
【點(diǎn)評(píng)】本題主要考查常見氣體的發(fā)生裝置與收集裝置的探究,發(fā)生裝置依據(jù)反應(yīng)物的狀態(tài)和反應(yīng)條件選擇,收集裝置依據(jù)氣體的密度和溶解性選擇.
22.遂川“狗牯腦”茶葉享譽(yù)天下,茶葉中含有豐富的有機(jī)物和無機(jī)物,某化學(xué)研究小組測(cè)定茶葉中鈣元素含量的實(shí)驗(yàn)方案如下:
【查閱資料】
(1)茶葉中鋁、鐵元素對(duì)鈣離子的測(cè)定有影響,所以要預(yù)先除去.
(2)溶液中鋁離子、鐵離子完全轉(zhuǎn)化為氫氧化物沉淀的pH在6左右,加熱有利于沉淀聚沉.
(3)茶葉中豐富的有機(jī)物來自于植物進(jìn)行了光合作用.
①稱取100g干燥的茶葉,充分灼燒使茶葉灰化,再用研缽磨細(xì)后移入燒杯中,然后加入一定量稀鹽酸,攪拌、過濾、洗滌.
②向步驟①所得濾液中逐滴加入稀氫氧化鈉溶液,調(diào)節(jié)溶液的pH為6~7左右,再加熱煮沸30min,過濾后得到濾液和沉淀.
③向步驟②所得的濾液中加入足量無水碳酸鈉,充分?jǐn)嚢瑁浞址磻?yīng)后,過濾、洗滌,得到濾液和沉淀.
請(qǐng)回答下列問題:
(1)步驟①中用到的玻璃儀器是 燒杯、漏斗、玻璃棒 ,灼燒灰化的目的是 除去茶葉中的有機(jī)物 .
(2)實(shí)驗(yàn)中用pH試紙測(cè)溶液pH值的方法是 用潔凈的玻璃棒蘸取待測(cè)液涂在pH試紙上,與標(biāo)準(zhǔn)比色卡對(duì)比讀數(shù) .
(3)寫出步驟②中生成紅褐色沉淀的化學(xué)方程式 3NaOH+FeCl3═Fe(OH)3↓+3NaCl .
(4)計(jì)算茶葉中鈣元素的含量還需要測(cè)定的數(shù)據(jù)是 ③中沉淀的質(zhì)量 .
【考點(diǎn)】34:化學(xué)實(shí)驗(yàn)方案設(shè)計(jì)與評(píng)價(jià);4G:過濾的原理、方法及其應(yīng)用;4U:溶液的酸堿度測(cè)定;95:堿的化學(xué)性質(zhì);G5:書寫化學(xué)方程式.
【分析】根據(jù)過濾操作的儀器解答;根據(jù)有機(jī)物容易燃燒生成水和二氧化碳等物質(zhì);根據(jù)測(cè)定溶液的pH的方法解答;根據(jù)氫氧化鈉能與氯化鐵反應(yīng)生成氫氧化鐵沉淀和氯化鈉解答;根據(jù)題意可以判斷需要的數(shù)據(jù).
【解答】解:(1)步驟①是過濾操作,用到的玻璃儀器是燒杯、漏斗、玻璃棒;灼燒灰化的目的是除去茶葉中的有機(jī)物.故填:燒杯、漏斗、玻璃棒;除去茶葉中的有機(jī)物.
(2)用pH試紙測(cè)溶液pH值,可以用潔凈的玻璃棒蘸取待測(cè)液涂在pH試紙上,與標(biāo)準(zhǔn)比色卡對(duì)比讀數(shù)即可,故填:用潔凈的玻璃棒蘸取待測(cè)液涂在pH試紙上,與標(biāo)準(zhǔn)比色卡對(duì)比讀數(shù);
(3)步驟②中生成紅褐色沉淀是氫氧化鈉與氯化鐵反應(yīng)生成氫氧化鐵沉淀和氯化鈉,故填:3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
(4)計(jì)算茶葉中鈣元素的含量需要測(cè)定的數(shù)據(jù)是茶葉質(zhì)量和③中沉淀的質(zhì)量,通過碳酸鈣的質(zhì)量可以計(jì)算鈣元素的質(zhì)量,再通過茶葉質(zhì)量(已知)可以計(jì)算鈣元素質(zhì)量分?jǐn)?shù).故填:③中沉淀的質(zhì)量.
【點(diǎn)評(píng)】合理設(shè)計(jì)實(shí)驗(yàn),科學(xué)地進(jìn)行實(shí)驗(yàn)、分析實(shí)驗(yàn),是得出正確實(shí)驗(yàn)結(jié)論的前提,因此要學(xué)會(huì)設(shè)計(jì)實(shí)驗(yàn)、進(jìn)行實(shí)驗(yàn)、分析實(shí)驗(yàn),為學(xué)好化學(xué)知識(shí)奠定基礎(chǔ).
23.通過“金屬和金屬材料”和“燃燒”的復(fù)習(xí),同學(xué)們對(duì)課本上“活動(dòng)性較強(qiáng)的金屬一般可以將位于其后面的金屬?gòu)乃鼈兊柠}溶液中置換出來”以及“支持燃燒的氣體一般是氧氣”這兩句話產(chǎn)生了質(zhì)疑.在老師的幫助下,用金屬鈉來探究下列問題:
提出問題:1、金屬鈉能否置換出硫酸銅溶液中的銅?
?? 2、金屬鈉能否在其他氣體(如:CO2)中燃燒?
資料查閱:金屬Na性質(zhì)活潑,常溫下,它極易與氧氣反應(yīng)生成白色固體氧化鈉,氧化鈉溶于水生成氫氧化鈉.金屬鈉還可以與水劇烈反應(yīng)放出氫氣.
實(shí)驗(yàn)探究:
實(shí)驗(yàn)一:①在實(shí)驗(yàn)室中,金屬鈉保存在煤油中;
②用鑷子從煤油中取出一小塊金屬鈉,用濾紙吸干表面煤油后投入硫酸銅溶液中,觀察到溶液中出現(xiàn)藍(lán)色沉淀,但沒有紅色的物質(zhì)析出;
③按照步驟②將金屬鈉投入水中,反應(yīng)結(jié)束后滴加酚酞溶液,發(fā)現(xiàn)溶液變紅.
實(shí)驗(yàn)二:將燃燒的鈉迅速伸入盛有CO2的集氣瓶中,觀察到鈉在CO2中繼續(xù)燃燒,反應(yīng)后冷卻,瓶?jī)?nèi)附著黑色顆粒,并粘附著白色物質(zhì).
問題討論
(1)根據(jù)上述資料寫出鈉塊投入水中所發(fā)生的反應(yīng)方程式: 2Na+2H2O=2NaOH+H2↑ .
(2)實(shí)驗(yàn)二中生成的黑色顆粒是 C (填化學(xué)式),而白色物質(zhì)可能是什么呢?
①同學(xué)們圍繞白色物質(zhì)可能是什么產(chǎn)生如下猜想:甲認(rèn)為白色物質(zhì)是氧化鈉,乙認(rèn)為是碳酸鈉,丙認(rèn)為是氧化鈉和碳酸鈉的混合物,丁認(rèn)為是氫氧化鈉.我認(rèn)為丁的猜想是錯(cuò)誤的,理由是 反應(yīng)物中沒有氫元素 .
②對(duì)白色物質(zhì)是什么進(jìn)行實(shí)驗(yàn)再探究,方案設(shè)計(jì)如下:
方案1:取該樣品少量于試管里,加入適量的水,振蕩,過濾,向?yàn)V液中加入無色酚酞試液,觀察到溶液變成紅色,結(jié)論:白色物質(zhì)中一定有氧化鈉.
方案2:取該樣品少量于試管里,滴加足量稀鹽酸,溶液中有氣泡冒出,結(jié)論:白色物質(zhì)中一定有 碳酸鈉 .
方案3:取該樣品少量于試管里,加入適量的水,振蕩,過濾,向?yàn)V液中加入過量的 B 溶液(填標(biāo)號(hào))(供選試劑:A、石灰水B、氯化鈣溶液 C、硫酸銅溶液),出現(xiàn)白色沉淀,然后過濾,再向溶液里滴加無色酚酞試液,無明顯現(xiàn)象出現(xiàn).則 乙 (在甲、乙、丙中選)的猜想成立.
③評(píng)價(jià)與反思:小娟同學(xué)認(rèn)為實(shí)驗(yàn)方案1得出的結(jié)論不正確,其理由是 碳酸鈉溶液也是堿性的 .實(shí)驗(yàn)室中的金屬鈉著火時(shí),你的滅火方法是 用黃沙掩埋 .
【考點(diǎn)】28:實(shí)驗(yàn)探究物質(zhì)的性質(zhì)或變化規(guī)律;85:金屬的化學(xué)性質(zhì);9H:鹽的化學(xué)性質(zhì);G1:質(zhì)量守恒定律及其應(yīng)用;G5:書寫化學(xué)方程式.
【分析】仔細(xì)閱讀材料后,發(fā)現(xiàn)是圍繞著金屬鈉的化學(xué)性質(zhì)進(jìn)行探究與分析,由于鈉是一種化學(xué)性質(zhì)非常活潑的金屬,因此就表現(xiàn)出一些特殊性質(zhì),同學(xué)們要拋卻思維定勢(shì),從資料查閱和實(shí)驗(yàn)現(xiàn)象入手大膽分析猜想,從而得出正確答案.
【解答】解:(1)金屬鈉可以與水劇烈反應(yīng)放出氫氣,可以理解為鈉置換出水中的氫,把水看做HOH就比較好理解了.
答案為:2Na+2H2O═2NaOH+H2↑
(2)鈉在CO2中燃燒后瓶?jī)?nèi)附著黑色顆粒,從反應(yīng)物的元素組成來分析,黑色顆粒只能是碳,而白色物質(zhì)可能是氧化鈉或碳酸鈉或二者的混合物,但不能是氫氧化鈉,因?yàn)榉磻?yīng)物中沒有氫元素.氧化鈉和水反應(yīng)生成氫氧化鈉,所以其水溶液呈堿性,碳酸鈉溶液也呈堿性,鑒別它們時(shí)不能只用酚酞,要鑒別碳酸根離子,
故答案為:C; ①反應(yīng)物中沒有氫元素,②碳酸鈉;B;乙;
③碳酸鈉溶液和氫氧化鈉溶液都呈堿性,故用酚酞不能鑒別,金屬鈉與水反應(yīng)放出氫氣,也能和二氧化碳反應(yīng),故金屬鈉著火時(shí)不能有水和二氧化碳滅火器,最好是用黃沙掩埋.
答案為:碳酸鈉溶液也是堿性的,用黃沙掩埋.
【點(diǎn)評(píng)】本題在同學(xué)們?cè)械闹R(shí)基礎(chǔ)上,進(jìn)一步對(duì)鈉的性質(zhì)進(jìn)行探究,既培養(yǎng)了同學(xué)們的分析能力,又與高中知識(shí)進(jìn)行接軌.
五、計(jì)算題(共10分)
24.(10分)(2017?吉安模擬)實(shí)驗(yàn)室有一瓶未知濃度的BaCl2溶液,某同學(xué)取出150g該溶液于燒杯中,向其中逐滴加入溶質(zhì)質(zhì)量分?jǐn)?shù)為26.5%的Na2CO3溶液,反應(yīng)過程中生成沉淀的質(zhì)量與所用Na2CO3溶液質(zhì)量的關(guān)系如圖所示.請(qǐng)計(jì)算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固體 21.2 g.
(2)BaCl2溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)是多少?(寫出計(jì)算過程,結(jié)果保留到0.1%)
(3)反應(yīng)前后溶液中鋇元素的質(zhì)量 減小 (填“增大”、“減小”或“不變”).
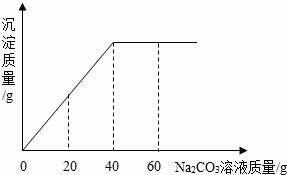
【考點(diǎn)】G6:根據(jù)化學(xué)反應(yīng)方程式的計(jì)算.
【分析】(1)根據(jù)溶質(zhì)的質(zhì)量的等于溶液的質(zhì)量乘以溶質(zhì)的質(zhì)量分?jǐn)?shù)求算;
(2)由圖可知,當(dāng)加入40g質(zhì)量分?jǐn)?shù)為26.5%的碳酸鈉溶液時(shí),沉淀達(dá)到最大量,結(jié)合對(duì)應(yīng)的化學(xué)方程式求算氯化鋇的質(zhì)量;
(3)由于反應(yīng)過程中鋇元素由離子狀態(tài)轉(zhuǎn)化為沉淀狀態(tài),所以溶液中的鋇元素的質(zhì)量在減少,加入40g碳酸鈉溶液時(shí)鋇元素在溶液中就沒有了.
【解答】解:
配制26.5%的Na2CO3溶液80g,需要Na2CO3固體的質(zhì)量為26.5%×80g=21.2g
由圖可知加入40g質(zhì)量分?jǐn)?shù)為26.5%的碳酸鈉溶液時(shí),沉淀達(dá)到最大量.此時(shí)參加反應(yīng)的碳酸鈉的質(zhì)量為26.5%×40g=10.6g
設(shè)BaCl2溶液的溶質(zhì)質(zhì)量為x
BaCl2+Na2CO3=BaCO3↓+2NaCl
208106
x??? 10.6g
![]() =
=![]()
x=20.8g
BaCl2溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)為![]() ×100%≈13.9%
×100%≈13.9%
由于反應(yīng)過程中鋇元素由離子狀態(tài)轉(zhuǎn)化為沉淀狀態(tài),所以溶液中的鋇元素的質(zhì)量在減少.
答:(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固體 21.2g.
(2)BaCl2溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)為13.9%;
(3)反應(yīng)前后溶液中鋇元素的質(zhì)量 減小
【點(diǎn)評(píng)】根據(jù)化學(xué)方程式計(jì)算時(shí),第一要正確書寫化學(xué)方程式,第二要使用正確的數(shù)據(jù),第三計(jì)算過程要完整.

孔乙己是貧困潦倒的知識(shí)分子。在書中,孔乙己是一個(gè)知識(shí)分子,滿口“之乎者也”,但是他很窮,還竊書,說過“讀書人的事,怎么能叫竊,”被人嘲笑,他...

自然界產(chǎn)生氧氣的化學(xué)方程式:光合作用的反應(yīng)式為6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反應(yīng)和暗反應(yīng)兩個(gè)過程。需要具備光...

有的高校沒有條件,只要學(xué)業(yè)水平成績(jī)都合格就可以,比如中國(guó)科學(xué)院大學(xué)。有的需要平常學(xué)習(xí)考試成績(jī),比如北京外國(guó)語大學(xué)要求高三第一學(xué)期期末成績(jī)?cè)谌?..

在四則運(yùn)算中,表示計(jì)算順序,在小括號(hào)之后、大括號(hào)之前;表示兩個(gè)整數(shù)的最小公倍數(shù);表示取未知數(shù)的整數(shù)部分;在函數(shù)中,表示函數(shù)的閉區(qū)間;在線性代...

濟(jì)南開設(shè)的最好的職高學(xué)校有:濟(jì)南方信集團(tuán)職業(yè)高中、濟(jì)南公共交通職業(yè)高中。濟(jì)南市公共交通職業(yè)高級(jí)中學(xué)是由濟(jì)南市公共交通總公司承辦,業(yè)務(wù)屬濟(jì)南市...

實(shí)然:是說事物實(shí)際上就是這樣的,但不同于現(xiàn)實(shí)性(現(xiàn)實(shí)性指其有合理性和客觀性);應(yīng)然:就是應(yīng)該是怎么樣的意思,比如說這件事,就應(yīng)該是那樣的結(jié)果...

地中海氣候一種夏季炎熱干燥、冬季溫和多雨,雨熱不同期的氣候類型。地中海氣候冬季受西風(fēng)帶控制,鋒面氣旋頻繁活動(dòng),氣候溫和,最冷月的氣溫在4-1...

堿石灰,又稱鈉石灰,堿石灰是白色或米黃色粉末,疏松多孔,是氧化鈣(CaO,大約75%),水(H?O,大約20%),氫氧化鈉(NaOH,大約3...