2017年安徽省黃山市中考化學模擬試卷(解析)
為了方便您的閱讀請點擊全屏查看
一、本大題包括10小題,每小題2分,共20分.每小題的4個選項中只有1個符合題意.
1.安徽省實施“清水藍天”工程以來,環境質量得到顯著提升.如圖行為不利于“清水藍天”工程實施的是
()
A.![]() 分類回收垃圾????????????? B.
分類回收垃圾????????????? B.![]() 使用太陽能路燈
使用太陽能路燈
C.![]() 開發氫能源電池客車????????????? D.
開發氫能源電池客車????????????? D.![]() 直接排放廢水
直接排放廢水
2.人類生活一刻也不能離開水,很多化學現象也與水有關,下列與水有關的現象的描述中發生了化學變化的是()
A.打開盛有濃鹽酸的試劑瓶時,在瓶口會出現白霧
B.塊狀的生石灰暴露在空氣中會變為變色固體
C.盛有濃硫酸的是試劑瓶在空氣中敞口放置時,溶液質量會增加
D.燒堿在空氣中敞口放置,表面會變得潮濕
3.“黃山毛峰”是我國著名的茶葉品牌,綠茶中含有的單寧酸(化學式為C76H52O46),具有抑制血壓上升、清熱解毒等功效,下列關于單寧酸的說法正確的是()
①由三種元素組成 ②由76個碳原子、52個氫原子和46個氧原子構成
③碳元素的質量分數最大 ④屬于化合物 ⑤碳、氧兩種元素的質量比為76:46.
A.①②③④⑤????????????? B.①②③④????????????? C.①③④????????????? D.①③⑤
4.航天探測發現:金星是一個被濃密大氣層包圍的固體球,大氣層的成分之一是C2O3實驗證明其化學性質與CO相似.下列關于C2O3的說法不正確的是()
A.C2O3中碳的化合價為+3
B.C2O3,能使紫色石蕊溶液變紅
C.在一定條件下C2O3能還原氧化鐵
D.C2O3充分燃燒的產物是CO2
5.如圖實驗操作正確的是()
A.![]() 吸取液體????????????? B.
吸取液體????????????? B.![]() 稀釋濃硫酸?????????????
稀釋濃硫酸?????????????
C.![]() 測定溶液的PH????????????? D.
測定溶液的PH????????????? D. 過濾
過濾
6.汞對環境和人類健康有較大的負面影響,為此,要在汞的生產、使用等環節加以嚴格控制,如圖是元素周期表中汞元素的信息示意圖,下列有關汞的說法錯誤的是()
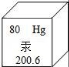
A.汞原子的核外電子數為80
B.汞原子比鐵原子質量大(鐵原子相對原子質量為56)
C.汞是常溫下呈液態的金屬,具有導電性
D.測體溫時,體溫計中的汞升高是因為分子間間隔變大了
7.向一定量黃銅(銅鋅合金)粉末中逐滴加入稀硫酸,下列圖象能正確表示對應變化關系的是()
A. ????????????? B.
????????????? B. ????????????? C.
????????????? C. ????????????? D.
????????????? D.
8.如圖是某化學反應的微觀模擬示意圖,下列說法正確的是()

A.該反應屬于置換反應
B.反應前后原子種類不變、數目改變
C.反應物中包含兩種化合物
D.發生反應的分子個數比為1:1
9.將一定量的鋅粉加入到硫酸亞鐵、硫酸銅和硫酸鎂的混合溶液中,過一段時間后過濾,向濾渣中加入稀鹽酸有氣泡產生,則下列敘述正確的是()
①濾渣中一定含有鋅? ②濾渣中一定含有銅,可能含有鋅
③向濾渣中加入稀鹽酸,最后溶液一定變成淺綠色? ④濾液中溶質一定含有硫酸鋅和硫酸鎂
⑤濾液的顏色不可能為淺綠色.
A.①④⑤????????????? B.②④????????????? C.②③④????????????? D.②③④⑤
10.如圖是A、B、C、三種物質的溶解度曲線,下列敘述正確的是()
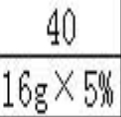
A.若要將組成在N點的A溶液轉變為M點的A溶液,可以采取恒溫蒸發溶劑的方法
B.t2℃時,A、C兩種物質溶液的溶質的質量分數一定相等
C.t2℃時,A、B兩種物質的飽和溶液降溫到t1℃,析出A的質量更大
D.t3℃時,三種物質的溶質質量分數大小順序為A>B>C
二、本大題包括5小題,共34分.
11.傳統干電池在日常生活中有多方面的應用,如圖顯示的是干電池的內部構造,請回答下列問題:
(1)干電池是把______能轉化為電能,寫出干電池正極材料主要成分的化學式:______;
(2)上述材料中屬于金屬材料的是______(寫一種);
(3)取干電池內的填充物溶于水,過濾,濾渣成分是MnO2和C,為了得到比較純凈的MnO2,可采用的簡單方法是______.
(4)MnO2在實驗室利用過氧化氫溶液制取O2中起的是______作用.
(5)糊狀A物質的成分之一是氯化銨,請你寫出該物質中陽離子的符號:______.

12.現有甲、乙、丙三個實驗裝置,請回答下列問題:
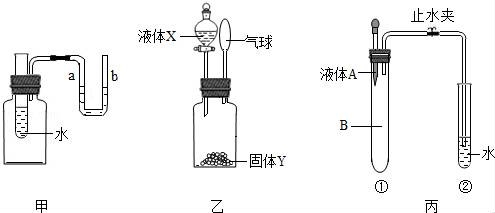
(1)往甲裝置中的試管內加入一定量的硝酸銨,過一段時間后可能觀察到的現象是______.
(2)圖乙中盛放液體X的儀器名稱 是______,按圖乙進行實驗時,發現小球鼓起來,如果實驗中發生了化學反應,則液體X和固體Y可能的組合是______(用化學方程式表示),如果實驗中沒有發生化學反應,則液體X和固體Y可能的組合是______.
(3)在按圖所示裝置進行實驗,首先將液體A滴入盛有氣體B的試管中,充分反應后,打開止水夾,發現水倒吸入試管①中,則液體A和其他B的可能是______.
(4)在進行上述甲乙丙三組實驗時,裝入藥品之前都要進行______.
13.為確定木炭還原氧化銅后的固體成分,請你與興趣小組的同學完成以下探究.
【對固體猜想】
猜想Ⅰ:全部是金屬銅;?? 猜想Ⅱ:除銅外,還含有氧化銅;
猜想Ⅲ:除銅外,還含有木炭;? 猜想Ⅳ:除銅外,還含有氧化銅、木炭
【進行實驗】實驗流程見如圖:
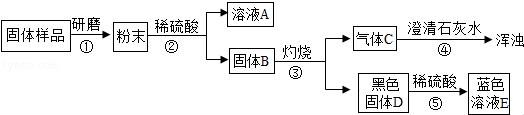
【問題和討論】
(1)步驟②包括溶解、______兩步操作;
(2)C的化學式為______,D的化學式為______,由此可以推出固體B中含有______(寫化學式),步驟④發生的反應方程式為______.
(3)結合(2)的結論推斷:如果溶液A顯藍色,則證明猜想______成立.CuSO4.
14.某校化學興趣小組的同學在實驗室整理化學藥品時,發現一瓶金屬鉻.為了解鉻與常見金屬鋁、銅在金屬活動性順序中的相對位置關系,他們進行了如下探究活動.
【查閱資料】鉻(Cr)是銀白色金屬,在空氣中表面能形成致密的氧化膜
【提出假設】考慮到鋁的活動性比銅強,提出了三種假設:
假設①:Al>Cr>Cu? 假設②:______;假設③:______.
【實驗過程】取大小相同的Cr、Cu、Al三種金屬薄片,用砂紙打磨光亮后,分別放入三支試管中,再分別加入等體積20%的稀硫酸.
【實驗現象】
金屬 | Cr | Cu | Al |
實驗現象 | 鉻片表面產生氣泡緩慢 | 銅表面無明顯變化 | 鋁表面產生氣泡較快 |
【實驗結論】假設成立______(填序號).
【問題與反思】
(1)由上述結論可知:鉻可以與硫酸銅溶液發生反應.請寫出該反應的化學方程式:______(已知在該反應的生成物中鉻元素顯+2價);
(2)小麗提出,按上述實驗操作,用硫酸銅溶液代替稀硫酸也能得出三種金屬的活動性順序,你認為______(填“可行”或“不可行”),理由是______.
15.某實驗小組的同學用氫氧化鈣溶液和鹽酸進行酸堿中和反應的實驗時,向燒杯中的氫氧化鈣溶液加入稀鹽酸一會后,發現忘記了滴加指示劑,因此,他們停止滴加稀鹽酸,并對燒杯內溶液中的溶質成分進行探究.
(1)寫出該中和反應的化學方程式______.
(2)探究燒杯內溶液中溶質的成分.
【提出問題】該燒杯內溶液中的溶質是什么?
【猜想】猜想①可能是CaCl2和Ca(OH)2;猜想②可能只有CaCl2;猜想③______.
【查閱資料】氯化鈣溶液呈中性
【進行實驗】
實驗步驟 | 實驗現象 | 結論 |
取少量燒杯內溶液于試管中,滴入幾滴酚酞溶液 |
______ | 猜想①錯誤 |
取少量燒杯內溶液于另一支試管中,加入______ |
______ | 猜想③正確 |
【反思】針對猜想③正確的溶液,要使其溶液中溶質只有CaCl2,應向燒杯中加入過量的______(填化學式).
【拓展】對于沒有明顯現象的化學變化,可以從反應物被消耗和相應生成物出現兩個方面甲乙證明,對于本題涉及的實驗,試從反應物是否被消耗的角度再設計兩種方案證明反應確實發生了.
實驗操作 | 預期實驗現象 |
______ |
______ |
______ |
______ |
三、本大題共6分.
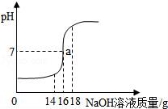
16.將5%的NaOH溶液逐滴加入到10g稀鹽酸中,邊加邊攪拌,隨著NaOH溶液的加入,溶液pH的變化如圖所示,邊回答:
(1)當恰好完全反應時,消耗NaOH溶液的質量為______g;
(2)計算稀鹽酸中溶質的質量分數.
2016年安徽省黃山市中考化學模擬試卷(5月份)
參考答案與試題解析
一、本大題包括10小題,每小題2分,共20分.每小題的4個選項中只有1個符合題意.
1.安徽省實施“清水藍天”工程以來,環境質量得到顯著提升.如圖行為不利于“清水藍天”工程實施的是
()
A. 分類回收垃圾????????????? B.
分類回收垃圾????????????? B. 使用太陽能路燈
使用太陽能路燈
C.![]() 開發氫能源電池客車????????????? D.
開發氫能源電池客車????????????? D.
????? 直接排放廢水
【考點】防治空氣污染的措施.
【分析】節約能源、減少污染,就可以利于“清水藍天”工程實施,如:對垃圾實行分類回收;加強生活污水處理;積極推廣太陽能、風能、地熱能及水能等系能源的使用,減少化石燃料的使用等.都是有利于“清水藍天”工程實施的.
【解答】解:A、分類回收垃圾,提高物質的利用率,減少環境污染,利于“清水藍天”工程實施,故不符合題意;
B、太陽能是新能源,可有效減少環境污染,有利于“清水藍天”工程實施,故不符合題意;
C、氫燃料是新能源,無污染,積極推廣新能源,可以保護環境,有利于“清水藍天”工程實施,故不符合題意;
D、直接排放廢水,會對環境造成嚴重的污染,不利于“清水藍天”工程實施,故符合題意.
故選D.
【點評】環境的保護已經越來越受到社會的關注,與之相關的問題,也就成為中考的熱點.
2.人類生活一刻也不能離開水,很多化學現象也與水有關,下列與水有關的現象的描述中發生了化學變化的是()
A.打開盛有濃鹽酸的試劑瓶時,在瓶口會出現白霧
B.塊狀的生石灰暴露在空氣中會變為變色固體
C.盛有濃硫酸的是試劑瓶在空氣中敞口放置時,溶液質量會增加
D.燒堿在空氣中敞口放置,表面會變得潮濕
【考點】化學變化和物理變化的判別.
【分析】化學變化是指有新物質生成的變化,物理變化是指沒有新物質生成的變化,化學變化與物理變化的本質區別是有無新物質生成,據此抓住化學變化和物理變化的區別結合事實進行分析判斷即可.
【解答】解:A、打開盛有濃鹽酸的試劑瓶時,在瓶口會出現白霧,是因為濃鹽酸具有揮發性,只是狀態發生改變,沒有新物質生成,屬于物理變化.
B、塊狀的生石灰暴露在空氣中會變為白色固體粉末,是因為氧化鈣與水反應生成氫氧化鈣,有新物質生成,屬于化學變化.
C、盛有濃硫酸的試劑瓶在空氣中敞口放置時,溶液質量會增加,是因為濃硫酸具有吸水性,沒有新物質生成,屬于物理變化.
D、燒堿在空氣中敞口放置,表面會變得潮濕,是因為氫氧化鈉吸收了空氣的水分發生潮解,沒有新物質生成,屬于物理變化.
故選B.
【點評】本題難度不大,解答時要分析變化過程中是否有新物質生成,這里的新物質是指和變化前的物質是不同種的物質,若沒有新物質生成屬于物理變化,若有新物質生成屬于化學變化.
3.“黃山毛峰”是我國著名的茶葉品牌,綠茶中含有的單寧酸(化學式為C76H52O46),具有抑制血壓上升、清熱解毒等功效,下列關于單寧酸的說法正確的是()
①由三種元素組成 ②由76個碳原子、52個氫原子和46個氧原子構成
③碳元素的質量分數最大 ④屬于化合物 ⑤碳、氧兩種元素的質量比為76:46.
A.①②③④⑤????????????? B.①②③④????????????? C.①③④????????????? D.①③⑤
【考點】化學式的書寫及意義;單質和化合物的判別;元素質量比的計算;元素的質量分數計算.
【分析】單寧酸由碳、氫、氧三種元素組成;每個單寧酸分子由76個碳原子、52個氫原子、46個氧原子構成;一個單寧酸分子中各種原子的個數比為:38:26:23;而各種元素的質量比為(12×76):(1×52):(16×46).
【解答】解:①單寧酸由碳、氫、氧三種元素組成,正確;②由化學式可知,單寧酸是由單寧酸分子構成的,每個單寧酸分子是由76個碳原子、52個氫原子和46個氧原子構成,錯誤;③根據化合物中各元素質量比=各元素的相對原子質量×原子個數之比,可得單寧酸中碳、氫、氧三種元素的質量比為:(12×76):52:(16×46)=228:13:184;可見其中碳元素的質量分數最大,正確;④單寧酸由碳、氫、氧三種元素組成純凈物,屬于化合物,正確;⑤單寧酸中碳、氧元素的質量比為:(12×76):(16×46)≠76:46,錯誤.
故選C.
【點評】本題難度不大,考查同學們結合新信息、靈活運用化學式的含義與有關計算進行分析問題、解決問題的能力.
4.航天探測發現:金星是一個被濃密大氣層包圍的固體球,大氣層的成分之一是C2O3實驗證明其化學性質與CO相似.下列關于C2O3的說法不正確的是()
A.C2O3中碳的化合價為+3
B.C2O3,能使紫色石蕊溶液變紅
C.在一定條件下C2O3能還原氧化鐵
D.C2O3充分燃燒的產物是CO2
【考點】化學式的書寫及意義;有關元素化合價的計算;質量守恒定律及其應用.
【分析】A、根據化合物中正負化合價代數和為零解答;B、根據一氧化碳的性質考慮C2O3是否能使石蕊溶液變色;C、根據一氧化碳的還原性考慮;D、根據一氧化碳燃燒的產物考慮.
【解答】解:A、設碳的化合價為X:X×2+(﹣2)×3=0解得X=+3,故A說法正確;
B、二氧化碳能使紫色石蕊溶液變紅,一氧化碳不能使紫色石蕊溶液變紅,因為C2O3實驗證明其化學性質與CO相似,所以也不能使紫色石蕊溶液變紅,故B說法錯誤;
C、一氧化碳具有還原性,能還原氧化鐵,又因為C2O3實驗證明其化學性質與CO相似,所以在一定條件下C2O3能還原氧化鐵,故C說法正確;
D、一氧化碳燃燒生成二氧化碳,因為C2O3實驗證明其化學性質與CO相似,所以C2O3充分燃燒的產物是CO2,故D說法正確.
故選B.
【點評】解答本題關鍵是要熟悉一氧化碳的性質:具有可燃性和還原性,還需要知道化合價的計算方法.
5.如圖實驗操作正確的是()
A.![]() 吸取液體????????????? B.
吸取液體????????????? B.![]() 稀釋濃硫酸?????????????
稀釋濃硫酸?????????????
C.![]() 測定溶液的PH????????????? D.
測定溶液的PH????????????? D. 過濾
過濾
【考點】液體藥品的取用;濃硫酸的性質及濃硫酸的稀釋;過濾的原理、方法及其應用;溶液的酸堿度測定.
【分析】A、根據液體藥品的取用、和膠頭滴管的使用方法進行分析判斷;
B、根據稀釋濃硫酸的方法進行分析判斷;
C、根據測定溶液的pH的方法進行分析判斷;
D、根據過濾液體時,要注意“一貼、二低、三靠”的原則進行分析判斷.
【解答】解:A、取用液體藥品時,瓶塞要倒放,吸取液體后的膠頭滴管不能平放或倒置,以防試劑會腐蝕橡膠帽,圖中所示操作錯誤;
B、稀釋濃硫酸時,要把濃硫酸緩緩地沿器壁注入水中,同時用玻璃棒不斷攪拌,以使熱量及時地擴散;一定不能把水注入濃硫酸中,圖中所示操作錯誤;
C、用pH試紙測定未知溶液的pH時,正確的操作方法為用玻璃棒蘸取少量待測液滴在干燥的pH試紙上,與標準比色卡對比來確定pH.不能將pH試紙伸入待測液中,以免污染待測液,圖中所示操作錯誤;
D、過濾液體時,要注意“一貼、二低、三靠”的原則,圖中所示操作正確.
故選:D.
【點評】本題難度不大,熟悉各種儀器的用途及使用注意事項、掌握常見化學實驗基本操作的注意事項是解答此類試題的關鍵.
6.汞對環境和人類健康有較大的負面影響,為此,要在汞的生產、使用等環節加以嚴格控制,如圖是元素周期表中汞元素的信息示意圖,下列有關汞的說法錯誤的是()
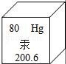
A.汞原子的核外電子數為80
B.汞原子比鐵原子質量大(鐵原子相對原子質量為56)
C.汞是常溫下呈液態的金屬,具有導電性
D.測體溫時,體溫計中的汞升高是因為分子間間隔變大了
【考點】元素周期表的特點及其應用;金屬的物理性質及用途;利用分子與原子的性質分析和解決問題.
【分析】根據圖中元素周期表可以獲得的信息:左上角的數字表示原子序數;字母表示該元素的元素符號;中間的漢字表示元素名稱;漢字下面的數字表示相對原子質量,進行分析判斷即可.
【解答】解:A、根據元素周期表中的一格可知,左上角的數字為80,表示原子序數為80;根據原子序數=核電荷數=質子數=核外電子數,則該元素的原子核外電子數為80,故選項說法正確.
B、根據元素周期表中的一格可知,漢字下面的數字表示相對原子質量,汞元素的相對原子質量為200.6;鐵原子相對原子質量為56,原子的相對原子質量與原子的質量呈正比,則汞原子比鐵原子質量大,故選項說法正確.
C、汞是常溫下呈液態的金屬,具有導電性,故選項說法正確.
D、測體溫時,體溫計中的汞升高,是因為汞原子間的間隔隨溫度的升高而變大了,故選項說法錯誤.
故選:D.
【點評】本題難度不大,考查學生靈活運用元素周期表中元素的信息(原子序數、元素符號、元素名稱、相對原子質量)進行分析解題的能力.
7.向一定量黃銅(銅鋅合金)粉末中逐滴加入稀硫酸,下列圖象能正確表示對應變化關系的是()
A. ????????????? B.
????????????? B. ????????????? C.
????????????? C. ????????????? D.
????????????? D.
【考點】金屬的化學性質.
【分析】根據銅鋅合金中只有鋅能夠和稀硫酸反應產生氫氣,反應前后鋅元素的質量不變以及反應前后溶液的酸堿性結合坐標逐項分析.
【解答】解:A、銅鋅合金中只有鋅能夠和稀硫酸反應產生氫氣,因此隨著反應的進行固體逐漸減少,到鋅反應完了,剩余的銅,質量保持不變,故坐標符合;
B、銅鋅合金中只有鋅能夠和稀硫酸反應產生氫氣,起點應該是0,故坐標錯誤;
C、銅鋅合金中只有鋅能夠和稀硫酸反應產生氫氣,只要一加稀硫酸會立即產生硫酸鋅,因此溶液中鋅的質量起點是0,故坐標錯誤;
D、隨著稀硫酸的加入產生硫酸鋅人顯中性,因此溶液的pH的起點是7,隨著硫酸的過量,溶液會顯酸性,pH<7,故坐標錯誤;
故選項為:A.
【點評】本題考查了常見物質的性質與曲線的關系,完成此題,解答本題的關鍵是要理解圖象的物理意義和所代表的反應的反應原理和相關物質的定量反應關系.
8.如圖是某化學反應的微觀模擬示意圖,下列說法正確的是()

A.該反應屬于置換反應
B.反應前后原子種類不變、數目改變
C.反應物中包含兩種化合物
D.發生反應的分子個數比為1:1
【考點】微粒觀點及模型圖的應用;單質和化合物的判別;反應類型的判定.
【分析】根據反應的微觀示意圖,該反應為一種化合物的4個分子與另一種單質的3個分子發生反應,生成一種單質的2個分子和一種化合物的6個分子,其中有一個單質的分子沒有參加反應,據此分析.
【解答】解:觀察反應的微觀示意圖,可知有一個單質的分子沒有參加反應,可以去掉,因此其反應的微觀過程為: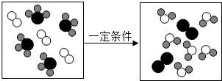
A、根據反應微觀示意圖中分子結構圖,該反應中反應物是一種化合物和一種單質,生成物是新的單質和新的化合物,屬于置換反應,故正確;
B、根據質量守恒定律結合微觀示意圖可知,反應前后原子種類、數目不改變,故錯;
C、該反應的反應物是一種化合物和一種單質,故錯;
D、根據反應微觀示意圖中分子結構圖,該反應為一種化合物的4個分子與另一種單質的3個分子發生反應,反應的分子個數比為4:3,故錯.
故答案為:A.
【點評】根據變化微觀示意圖及粒子構成模擬圖,根據分子由原子構成等特點,正確判斷變化中的物質構成,是解答本題的基本方法.還需要知道由同種原子構成的分子構成的物質是單質,由不同種原子構成的分子構成的物質是化合物.
9.將一定量的鋅粉加入到硫酸亞鐵、硫酸銅和硫酸鎂的混合溶液中,過一段時間后過濾,向濾渣中加入稀鹽酸有氣泡產生,則下列敘述正確的是()
①濾渣中一定含有鋅? ②濾渣中一定含有銅,可能含有鋅
③向濾渣中加入稀鹽酸,最后溶液一定變成淺綠色? ④濾液中溶質一定含有硫酸鋅和硫酸鎂
⑤濾液的顏色不可能為淺綠色.
A.①④⑤????????????? B.②④????????????? C.②③④????????????? D.②③④⑤
【考點】金屬的化學性質.
【分析】向濾渣中加入稀鹽酸有氣泡產生,說明有排在氫前面的金屬;有兩種情況:第一鋅過量,這時濾渣中不僅有過量的鋅,還有生成的鐵和銅;還有一種可能就是濾渣中含有鐵,則一定含有置換出來的銅,再進行分析即可.
【解答】解:向濾渣中加入稀鹽酸有氣泡產生,說明有排在氫前面的金屬;有兩種情況:第一鋅過量,這時濾渣中不僅有過量的鋅,還有生成的鐵和銅;還有一種可能就是濾渣中含有鐵,則一定含有置換出來的銅.
①濾渣中不一定含有鋅可能是鐵和銅,故①錯誤; ②濾渣中一定含有鐵和銅,可能含有鋅故②錯;③向濾渣中加入稀鹽酸,最后溶液不一定變成淺綠色,因為濾渣中可能含有生成的鐵; ④濾液中溶質一定含有硫酸鋅和硫酸鎂;⑤濾液的顏色可能為淺綠色.
故選B.
【點評】解答本題關鍵是要知道金屬的化學性質,并能靈活運用.
10.如圖是A、B、C、三種物質的溶解度曲線,下列敘述正確的是()
A.若要將組成在N點的A溶液轉變為M點的A溶液,可以采取恒溫蒸發溶劑的方法
B.t2℃時,A、C兩種物質溶液的溶質的質量分數一定相等
C.t2℃時,A、B兩種物質的飽和溶液降溫到t1℃,析出A的質量更大
D.t3℃時,三種物質的溶質質量分數大小順序為A>B>C
【考點】固體溶解度曲線及其作用;飽和溶液和不飽和溶液相互轉變的方法;晶體和結晶的概念與現象;溶質的質量分數.
【分析】根據固體的溶解度曲線可以:①查出某物質在一定溫度下的溶解度,從而確定物質的溶解性,②比較不同物質在同一溫度下的溶解度大小,從而判斷飽和溶液中溶質的質量分數的大小,③判斷物質的溶解度隨溫度變化的變化情況,從而判斷通過降溫結晶還是蒸發結晶的方法達到提純物質的目的.
【解答】解:A、t3℃時N點表示A的不飽和溶液,M點表示A的變化溶液,所以若要將組成在N點的A溶液轉變為M點的A溶液,可以采取恒溫蒸發溶劑的方法,故A正確;
B、t2℃時,A、C兩種物質飽和溶液的溶質的質量分數一定相等,故B錯誤;
C、t2℃時,A、B兩種物質的飽和溶液的質量不確定,析出晶體的質量就不確定,故C錯誤;
D、t3℃時,三種物質的飽和溶液溶質質量分數大小順序為:A>B>C,故D錯誤.
故選:A.
【點評】本題難度不是很大,主要考查了固體的溶解度曲線所表示的意義,及根據固體的溶解度曲線來解決相關的問題,從而培養分析問題、解決問題的能力.
二、本大題包括5小題,共34分.
11.傳統干電池在日常生活中有多方面的應用,如圖顯示的是干電池的內部構造,請回答下列問題:
(1)干電池是把 化學 能轉化為電能,寫出干電池正極材料主要成分的化學式: C ;
(2)上述材料中屬于金屬材料的是 銅 (寫一種);
(3)取干電池內的填充物溶于水,過濾,濾渣成分是MnO2和C,為了得到比較純凈的MnO2,可采用的簡單方法是 在空氣中充分灼燒 .
(4)MnO2在實驗室利用過氧化氫溶液制取O2中起的是 催化 作用.
(5)糊狀A物質的成分之一是氯化銨,請你寫出該物質中陽離子的符號: NH4+ .
【考點】物質發生化學變化時的能量變化;催化劑的特點與催化作用;金屬材料及其應用;碳的化學性質;化學式的書寫及意義;化學符號及其周圍數字的意義.
【分析】(1)根據能量的轉化方式分析,電池是把化學能轉化為電能的裝置.
(2)根據已有的材料的類別結合物質的成分進行分析解答即可.
(3)根據碳的性質分析;
(4)二氧化錳可以用作過氧化氫分解制取氧氣的催化劑,也可以用作氯酸鉀制取氧氣的催化劑;
(5)氯化銨是由銨根離子和氯離子構成的.
【解答】解:(1)干電池放電時是通過化學變化產生能量,把化學能轉化為電能.干電池正極是碳棒,材料主要成分的化學式:C.
(2)金屬材料包括純金屬和合金,干電池中銅帽、鋅皮都屬于金屬材料.
(3)由于碳可以與空氣中的氧氣反應生成二氧化碳,而二氧化錳不可以,所以從MnO2和C中得到比較純凈的MnO2,可以在空氣中充分灼燒;
(4)實驗室制氧氣常用MnO2作催化劑;
(5)氯化銨是由銨根離子和氯離子構成的,其中的陽離子是銨根離子,故填:NH4+;
故答案為:(1)化學;C(2)銅或鋅;(3)在空氣中充分灼燒;(4)催化;(5)NH4+.
【點評】本考點基礎性比較強,與課本知識緊密相連,同學們要加強記憶,了解能量之間的相互轉化、物質的組成和性質.
12.現有甲、乙、丙三個實驗裝置,請回答下列問題:
(1)往甲裝置中的試管內加入一定量的硝酸銨,過一段時間后可能觀察到的現象是 a端液面升高,b端液面下降 .
(2)圖乙中盛放液體X的儀器名稱 是 分液漏斗 ,按圖乙進行實驗時,發現小球鼓起來,如果實驗中發生了化學反應,則液體X和固體Y可能的組合是 CaCO3+2HCl=CaCl2+H2O+CO2↑ (用化學方程式表示),如果實驗中沒有發生化學反應,則液體X和固體Y可能的組合是 X氫氧化鈉和Y水 .
(3)在按圖所示裝置進行實驗,首先將液體A滴入盛有氣體B的試管中,充分反應后,打開止水夾,發現水倒吸入試管①中,則液體A和其他B的可能是 A液是氫氧化鈉溶液;B氣體是二氧化碳 .
(4)在進行上述甲乙丙三組實驗時,裝入藥品之前都要進行 裝置氣密性檢查 .
【考點】物質的鑒別、推斷;溶解時的吸熱或放熱現象;書寫化學方程式、.
【分析】(1)根據圖甲瓶中的壓強的變化來分析a、b液面的變化;
(2)根據常用儀器的名稱常識判斷圖乙中盛放液體X的儀器名稱;要使圖示的小氣球鼓起來,就要使瓶內壓強增大,要使瓶內壓強增大可通過升溫或放出氣體實現.即要使小氣球鼓起來,所加入的液體與瓶中固體要么放出大量的熱要么生成氣體;
(3)可以根據實驗現象進行分析、判斷,從而得出正確的結論A液是氫氧化鈉溶液; B氣體是二氧化碳;
(4)在進行有氣體參與實驗時,裝入藥品之前都要進行裝置氣密性檢查.
【解答】解:(1)硝酸銨溶于水時吸收熱量,瓶中氣溫降低,氣體收縮體積變小,瓶內壓強減小,故a端液面升高,b端液面下降;
(2)圖乙中盛放液體X的儀器名稱是分液漏斗;
①碳酸鈉和稀鹽酸反應放出大量氣體二氧化碳,瓶內氣體增多壓強增大,小氣球鼓起來;
②氧化鈣和水反應時放出大量的熱,瓶中氣溫升高氣體膨脹體積變大,瓶內壓強增大,小氣球鼓起來;
③碳酸鈣和稀鹽酸反應放出大量氣體二氧化碳,瓶內氣體增多壓強增大,小氣球鼓起來.
氫氧化鈉溶于水時溶解放出大量的熱,瓶中氣溫升高氣體膨脹體積變大,瓶內壓強增大,小氣球鼓起來;
根據以上知識選擇給出答案:分液漏斗;CaCO3+2HCl=CaCl2+H2O+CO2↑;X氫氧化鈉和Y水;
(3)將液體A滴入盛有氣體B的試管中,充分反應后,打開止水夾,發現水倒吸入試管①中,說明①試管中液體A滴入與氣體B接觸時發生了化學反應,氣體減少.例如氫氧化鈉溶液和二氧化碳反應生成碳酸鈉,消耗了二氧化碳氣體;
(4)在進行有氣體參與實驗時,裝入藥品之前都要進行裝置氣密性檢查.
故答案是:(1)a端液面升高,b端液面下降;
(2)分液漏斗;CaCO3+2HCl=CaCl2+H2O+CO2↑;X氫氧化鈉和Y水;
(3)A液是氫氧化鈉溶液; B氣體是二氧化碳;
(4)裝置氣密性檢查.
【點評】解答本題要充分理解產生實驗現象的原因,能夠根據實驗現象分析、判斷物質之間相互作用的實質.氫氧化鈉、氧化鈣、濃硫酸三種物質放入水中,放出大量熱;硝酸銨溶解吸收熱量.
13.為確定木炭還原氧化銅后的固體成分,請你與興趣小組的同學完成以下探究.
【對固體猜想】
猜想Ⅰ:全部是金屬銅;?? 猜想Ⅱ:除銅外,還含有氧化銅;
猜想Ⅲ:除銅外,還含有木炭;? 猜想Ⅳ:除銅外,還含有氧化銅、木炭
【進行實驗】實驗流程見如圖:
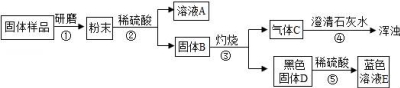
【問題和討論】
(1)步驟②包括溶解、 過濾 兩步操作;
(2)C的化學式為 CO2 ,D的化學式為 CuO ,由此可以推出固體B中含有 Cu、C (寫化學式),步驟④發生的反應方程式為 CO2+Ca(OH)2═CaCO3↓+H2O .
(3)結合(2)的結論推斷:如果溶液A顯藍色,則證明猜想 Ⅳ 成立.CuSO4.
【考點】實驗探究物質的組成成分以及含量;金屬的化學性質;酸的化學性質;碳的化學性質;書寫化學方程式、.
【分析】【問題和討論】(1)根據固體和液體分離來考慮操作步驟;根據溶解于過濾用到的儀器考慮共同使用的玻璃儀器;(2)通過氣體通入澄清石灰水中變渾濁考慮氣體成分;根據黑色固體與硫酸反應生成藍色溶液考慮D的化學式;根據固體B灼燒后生成二氧化碳和氧化銅來分析固體B的組成;根據方程式的寫法寫出方程式;(3)根據藍色溶液是銅離子溶液,因為通過后面的推斷已經知道一定含有碳了,關鍵是再通過對氧化銅的判斷來考慮猜想幾正確.
【解答】解:【問題和討論】(1)固體粉末最后變成固體與液體分離,所以要先將粉末溶解,進行過濾將不溶于液體的固體與液體分離開;
(2)氣體通入澄清石灰水中變渾濁,說明該氣體是二氧化碳;由于黑色固體與硫酸反應生成藍色溶液,說明黑色固體中含有銅元素,又因為銅與硫酸不反應,所以黑色固體是氧化銅;由于固體B經過灼燒生成二氧化碳和氧化銅,所以固體B中含有木炭和銅;二氧化碳和石灰水反應生成碳酸鈣沉淀和水,反應的化學方程式為:CO2+Ca(OH)2═CaCO3↓+H2O.
(3)由于粉末與硫酸反應生成藍色溶液A,所以A中溶質是硫酸銅,由于銅與硫酸不反應,所以說明粉末中一定含有氧化銅,由于通過后面的推斷已經知道其中一定含有木炭了,所以再含有氧化銅時,猜想Ⅳ就正確了.
故答案為:(1)過濾;(2)CO2;CuO;Cu、C;CO2+Ca(OH)2═CaCO3↓+H2O;(3)Ⅳ.
【點評】解答本題的關鍵是找出突破口,能使澄清石灰水變渾濁的氣體是二氧化碳,黑色固體與硫酸反應生成藍色溶液,說明黑色固體中含有氧化銅,再進行進一步分析.
14.某校化學興趣小組的同學在實驗室整理化學藥品時,發現一瓶金屬鉻.為了解鉻與常見金屬鋁、銅在金屬活動性順序中的相對位置關系,他們進行了如下探究活動.
【查閱資料】鉻(Cr)是銀白色金屬,在空氣中表面能形成致密的氧化膜
【提出假設】考慮到鋁的活動性比銅強,提出了三種假設:
假設①:Al>Cr>Cu? 假設②: Cr>Al>Cu ;假設③: Al>Cu>Cr .
【實驗過程】取大小相同的Cr、Cu、Al三種金屬薄片,用砂紙打磨光亮后,分別放入三支試管中,再分別加入等體積20%的稀硫酸.
【實驗現象】
金屬 | Cr | Cu | Al |
實驗現象 | 鉻片表面產生氣泡緩慢 | 銅表面無明顯變化 | 鋁表面產生氣泡較快 |
【實驗結論】假設成立 ① (填序號).
【問題與反思】
(1)由上述結論可知:鉻可以與硫酸銅溶液發生反應.請寫出該反應的化學方程式: Cr+CuSO4=CrSO4+Cu (已知在該反應的生成物中鉻元素顯+2價);
(2)小麗提出,按上述實驗操作,用硫酸銅溶液代替稀硫酸也能得出三種金屬的活動性順序,你認為 不可行 (填“可行”或“不可行”),理由是 無法比較鉻和鋁的金屬活動性強弱 .
【考點】金屬活動性的探究;書寫化學方程式、.
【分析】【提出假設】根據鋁的活動性比銅強,可對鉻的活動性作出假設.
【實驗結論】由實驗現象:鉻片表面產生氣泡緩慢,銅表面無明顯變化,鋁表面產生氣泡較快,進行分析解答.
【問題與反思】(1)鉻可以與硫酸銅溶液發生反應,根據題意在該反應的生成物中鉻元素顯+2價,故生成CrSO4和銅,進行分析解答.
(2)根據鋁、鉻均能與硫酸銅溶液發生反應,進行分析解答.
【解答】解:【提出假設】鋁的活動性比銅強,故還可以提出:Cr>Al>Cu、Al>Cu>Cr的假設.
【實驗結論】鉻片表面產生氣泡緩慢,鋁表面產生氣泡較快,說明鋁、鉻的金屬活動性比氫強,且鋁的金屬活動性比鋁強;銅表面無明顯變化,說明銅的位置排在氫的后面,三種金屬在金屬活動性順序中的相對位置關系是Al>Cr>Cu.
【問題與反思】(1)鉻可以與硫酸銅溶液發生反應,根據題意在該反應的生成物中鉻元素顯+2價,故生成CrSO4和Cu,反應的化學方程式為:Cr+CuSO4=CrSO4+Cu.
(2)鋁、鉻均能與硫酸銅溶液發生反應,說明了活動性鋁>銅,鉻>銅,但無法確定鋁和鉻的活動性強弱,故方案不可行.
故答案為:【提出假設】假設②:Cr>Al>Cu;假設③:Al>Cu>Cr.
【實驗結論】①;
【問題與反思】(1)Cr+CuSO4=CrSO4+Cu;(2)不可行,無法比較鉻和鋁的金屬活動性強弱.
【點評】本題難度不是很大,通過實驗探究來判斷金屬的活動性強弱,實驗設計時靈活運用“反應則活潑、不反應則不活潑”是正確解答此類題的關鍵.
15.某實驗小組的同學用氫氧化鈣溶液和鹽酸進行酸堿中和反應的實驗時,向燒杯中的氫氧化鈣溶液加入稀鹽酸一會后,發現忘記了滴加指示劑,因此,他們停止滴加稀鹽酸,并對燒杯內溶液中的溶質成分進行探究.
(1)寫出該中和反應的化學方程式 Ca(OH)2+2HCl═CaCl2+2H2O .
(2)探究燒杯內溶液中溶質的成分.
【提出問題】該燒杯內溶液中的溶質是什么?
【猜想】猜想①可能是CaCl2和Ca(OH)2;猜想②可能只有CaCl2;猜想③ CaCl2、HCl .
【查閱資料】氯化鈣溶液呈中性
【進行實驗】
實驗步驟 | 實驗現象 | 結論 |
取少量燒杯內溶液于試管中,滴入幾滴酚酞溶液 |
酚酞溶液沒有變色 | 猜想①錯誤 |
取少量燒杯內溶液于另一支試管中,加入 幾滴紫色的石蕊試液 |
石蕊試液變紅色 | 猜想③正確 |
【反思】針對猜想③正確的溶液,要使其溶液中溶質只有CaCl2,應向燒杯中加入過量的 CaCO3 (填化學式).
【拓展】對于沒有明顯現象的化學變化,可以從反應物被消耗和相應生成物出現兩個方面甲乙證明,對于本題涉及的實驗,試從反應物是否被消耗的角度再設計兩種方案證明反應確實發生了.
實驗操作 | 預期實驗現象 |
在石灰水中加入鋅粒,然后逐漸加入稀鹽酸 |
如果一段時間后鋅粒表面有氣泡冒出 |
在石灰水中加入幾小塊石灰石,然后逐漸加入稀鹽酸 |
如果一段時間后石灰石表面有氣泡冒出 |
【考點】實驗探究物質的組成成分以及含量;酸的化學性質;堿的化學性質;中和反應及其應用;書寫化學方程式、.
【分析】(1)根據氫氧化鈣和鹽酸反應生成了氯化鈣和水寫出反應的方程式;
(2)猜想③根據反應的程度進行猜想:恰好反應、一種物質完全反應,另一種物質有剩余;
【實驗探究】
Ⅰ根據酚酞遇堿變紅來進行解答;
Ⅱ根據鹽酸的化學性質分析;
【反思】
根據廢液呈酸性,以及鹽酸的性質進行分析,但注意不能引進其它的金屬離子.
【拓展】根據鹽酸的性質進行分析.
【解答】解:
(1)氫氧化鈣和鹽酸反應生成了氯化鈣和水,因此反應的方程式為:Ca(OH)2+2HCl═CaCl2+2H2O;
(2)猜想:反應可能是恰好反應,只有氯化鈣、也可能是一種物質完全反應,另一種物質有剩余,若氫氧化鈣過量,則含有氫氧化鈣和氯化鈣;若鹽酸過量,則含有鹽酸和氯化鈣;
【實驗探究】Ⅰ因為酚酞遇堿會變紅色,無色酚酞溶液不變色,說明反應后的溶液不呈堿性.而猜想①中含有Ca(OH)2,溶液應呈堿性,所以排除猜想①;
Ⅱ根據鹽酸的化學性質可設計實驗如下:
實 驗 步 驟 | 實 驗 現 象 | 結? 論 |
取少量燒杯內溶液于試管中,滴入幾滴酚酞溶液 | 酚酞溶液沒有變色 | 猜想①錯誤 |
取少量燒杯內溶液于另一支試管中,加入 幾滴紫色的石蕊試液 | 石蕊試液變紅色 | 猜想③正確 |
【反思】
廢液呈酸性,會腐蝕鐵質下水管(或污染水源);除去溶液中的鹽酸可用適量的碳酸鈣,碳酸鈣和鹽酸反應生成氯化鈣、水和二氧化碳.
【拓展】由于當酸與其他物質反應時,酸堿中和會優先進行,所以從反應物是否被消耗的角度設計實驗,可以在石灰水中加入鋅粒(或幾小塊石灰石),然后逐漸加入稀鹽酸,如果一段時間后鋅粒(或石灰石)表面有氣泡冒出,說明進行了反應.
故答案為:
(1)Ca(OH)2+2HCl═CaCl2+2H2O
(2)【猜想與假設】CaCl2、HCl
【實驗探究】
實 驗 步 驟 | 實 驗 現 象 | 結? 論 |
取少量燒杯內溶液于試管中,滴入幾滴酚酞溶液 | 酚酞溶液沒有變色 | 猜想①錯誤 |
取少量燒杯內溶液于另一支試管中,加入 幾滴紫色的石蕊試液 | 石蕊試液變紅色 | 猜想③正確 |
【其他合理答案及表述也可,例如:可以選用鋅粒等活潑金屬、氧化銅(或氧化鐵)等金屬氧化物、氫氧化銅(或氫氧化鐵)等堿、碳酸鈉等碳酸鹽】
【反思與拓展】CaCO3.
實驗操作 | 預期實驗現象 |
在石灰水中加入鋅粒,然后逐漸加入稀鹽酸 |
如果一段時間后鋅粒表面有氣泡冒出 |
在石灰水中加入幾小塊石灰石,然后逐漸加入稀鹽酸 |
如果一段時間后石灰石表面有氣泡冒出 |
【點評】本題考查了酸堿中和反應以及實驗設計的能力.設計實驗時,可以從反應后的產物和其有關的性質著手。
三、本大題共6分.
16.將5%的NaOH溶液逐滴加入到10g稀鹽酸中,邊加邊攪拌,隨著NaOH溶液的加入,溶液pH的變化如圖所示,邊回答:
(1)當恰好完全反應時,消耗NaOH溶液的質量為 16 g;
(2)計算稀鹽酸中溶質的質量分數.
【考點】根據化學反應方程式的計算;有關溶質質量分數的簡單計算.
【分析】氫氧化鈉和稀鹽酸反應生成氯化鈉和水,根據反應的化學方程式和提供的數據可以進行相關方面的計算.
【解答】解:(1)當恰好完全反應時,消耗NaOH溶液的質量為16g;
故填:16.
(2)設稀鹽酸中氯化氫的質量為x,
NaOH+HCl═NaCl+H2O,
40????? 36.5
16g×5%? x
=,
x=0.73g,
稀鹽酸中溶質的質量分數為:![]() ×100%=7.3%,
×100%=7.3%,
答:稀鹽酸中溶質的質量分數為7.3%.
【點評】本題主要考查學生運用假設法和化學方程式進行計算和推斷的能力,計算時要注意規范性和準確性.
第1頁(共21頁)

孔乙己是貧困潦倒的知識分子。在書中,孔乙己是一個知識分子,滿口“之乎者也”,但是他很窮,還竊書,說過“讀書人的事,怎么能叫竊,”被人嘲笑,他...

自然界產生氧氣的化學方程式:光合作用的反應式為6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反應和暗反應兩個過程。需要具備光...

有的高校沒有條件,只要學業水平成績都合格就可以,比如中國科學院大學。有的需要平常學習考試成績,比如北京外國語大學要求高三第一學期期末成績在全...

在四則運算中,表示計算順序,在小括號之后、大括號之前;表示兩個整數的最小公倍數;表示取未知數的整數部分;在函數中,表示函數的閉區間;在線性代...

濟南開設的最好的職高學校有:濟南方信集團職業高中、濟南公共交通職業高中。濟南市公共交通職業高級中學是由濟南市公共交通總公司承辦,業務屬濟南市...

實然:是說事物實際上就是這樣的,但不同于現實性(現實性指其有合理性和客觀性);應然:就是應該是怎么樣的意思,比如說這件事,就應該是那樣的結果...

地中海氣候一種夏季炎熱干燥、冬季溫和多雨,雨熱不同期的氣候類型。地中海氣候冬季受西風帶控制,鋒面氣旋頻繁活動,氣候溫和,最冷月的氣溫在4-1...

堿石灰,又稱鈉石灰,堿石灰是白色或米黃色粉末,疏松多孔,是氧化鈣(CaO,大約75%),水(H?O,大約20%),氫氧化鈉(NaOH,大約3...